题目内容
17.利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)制备铁红,大致生产过程如下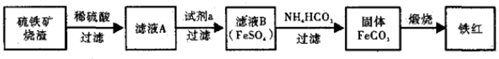
请回答:
(1)验滤液A 中含有Fe2+的方法是取少量滤液A于试管中,向试管中滴加酸性高锰酸钾溶液,若溶液褪色,则说明存在Fe2+.
(2)滤液A→B发生反应的离子方程式为2Fe3++Fe=3Fe2+.
(3)在空气中煅烧FeCO3的方程式为4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
分析 硫铁矿烧渣含有Fe2O3、FeO、SiO2等,加入稀硫酸,二氧化硅不反应,滤液含有Fe2+、Fe3+,加入试剂a后得到滤液B含有FeSO4,说明Fe3+被还原,则a为Fe,在滤液中加入碳酸氢铵,可得到FeCO3,煅烧得到Fe2O3,以此解答该题.
解答 解:(1)Fe2+具有还原性,可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,检验方法为取少量滤液A于试管中,向试管中滴加酸性高锰酸钾溶液,若溶液褪色,则说明存在Fe2+,
故答案为:取少量滤液A于试管中,向试管中滴加酸性高锰酸钾溶液,若溶液褪色,则说明存在Fe2+;
(2)滤液A→B为铁离子与铁的反应,发生反应的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(3)在空气中煅烧FeCO3生成氧化铁和二氧化碳,亚铁被氧化,应有氧气参加反应,方程式为4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
点评 本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握实验的流程和制备原理,难度中等.

练习册系列答案
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
5.下列各组离子能在指定环境下大量共存的是( )
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
12.工业制备氯化铜时,将浓盐酸加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤.请回答以下问题:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
(1)将浓盐酸溶解粗CuO粉末后,溶液中的金属阳离子含有Cu2+、Fe2+、Fe3+、H+,第一步除去该溶液中的Fe2+,能否直接调整溶液pH=9.6,将Fe2+沉淀除去?不能,(填“能”或“不能”)理由是因Fe2+沉淀的pH最大,Fe2+沉淀完全时,Cu2+、Fe3+也会沉淀完全
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:你认为用NaClO作氧化剂是否妥当?否(填“是”或“否”),现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有BD(有几个选几个,填代号,下同).
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)①加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的AD.
A.CuO B.NH3•H2O C.NaOH D.Cu(OH)2
②加上述物质调节溶液的PH为3.2~4.7,原因是铁离子沉淀完全时的PH值为3.2,铜离子开始沉淀时的PH值为4.7,除杂时要使铁离子沉淀完全,不能使铜离子产生沉淀
(4)最后能不能直接将溶液蒸发得到CuCl2•2H2O?不能(填“能”或者“不能”).若不能,应该如何操作才能得到CuCl2•2H2O应在氯化氢气氛中浓缩后冷却结晶(若填“能”,此空不用回答)
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9 | 6.7 |
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:你认为用NaClO作氧化剂是否妥当?否(填“是”或“否”),现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有BD(有几个选几个,填代号,下同).
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)①加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的AD.
A.CuO B.NH3•H2O C.NaOH D.Cu(OH)2
②加上述物质调节溶液的PH为3.2~4.7,原因是铁离子沉淀完全时的PH值为3.2,铜离子开始沉淀时的PH值为4.7,除杂时要使铁离子沉淀完全,不能使铜离子产生沉淀
(4)最后能不能直接将溶液蒸发得到CuCl2•2H2O?不能(填“能”或者“不能”).若不能,应该如何操作才能得到CuCl2•2H2O应在氯化氢气氛中浓缩后冷却结晶(若填“能”,此空不用回答)
9.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到表1的数据:
表1
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热
(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84(m{\;}_{1}-m{\;}_{2})}{31m{\;}_{1}}$×100%(用代数式表示).
附表:溶解度表
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到表1的数据:
表1
 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热
(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84(m{\;}_{1}-m{\;}_{2})}{31m{\;}_{1}}$×100%(用代数式表示).
附表:溶解度表
 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
6.氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2,部分装置如图所示,回答以下问题:
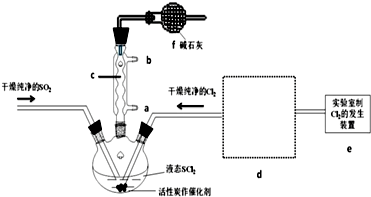
(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解.
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解.
(4)下列四种制备SO2的方案中最佳选择是丁.
(5)装置e中产生的Cl2经过d后进入三颈烧瓶,请在d的虚线框内画出所需实验装置图,并标出试剂.
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏;(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).

(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解.
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解.
(4)下列四种制备SO2的方案中最佳选择是丁.
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 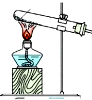 | 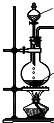 | 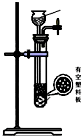 | 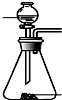 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4 | 4mol/LHNO3+NaHSO3 | 70%NaHSO4+K2SO3 |
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏;(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.