题目内容
已知拆开1mol H-H键、1molN≡N和1mol N-H键分别需要的能量是436kJ、948kJ、391kJ.则N2、H2合成NH3的热化学方程式为: .
考点:热化学方程式
专题:化学反应中的能量变化
分析:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答:
解:在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+948kJ=2256kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2256kJ=90kJ,则标注物质聚集状态和对应焓变写出热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-90kJ?mol-1;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-90kJ?mol-1.
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-90kJ?mol-1.
点评:本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
某气体的摩尔质量为M g?mol-1,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x.则
表示的是( )
| Mx |
| VNA |
| A、该气体的密度(以g/L为单位) |
| B、VL该气体的质量(以g为单位) |
| C、1mol该气体的体积(以L为单位) |
| D、1L该气体中所含的分子数 |
几种短周期元素的原子半径及主要化合价如下表
下列说法正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、离子半径大小:r(M3+)>r(T2-) |
| B、R的氧化物对应的水化物不可能具有两性 |
| C、X单质在氧气中燃烧生成XO3 |
| D、L、T形成的简单离子核外电子数相等 |
反应:CaCl2+CO2+H2O=CaCO3+2HCl在任何情况下都不能发生反应,原因是该反应( )
| A、△H>0△S>0 |
| B、△H<0△S<0 |
| C、△H<0△S>0 |
| D、△H>0△S<0 |
下列物质中,所含氢原子的数目最大的是( )
| A、18g冰 |
| B、标准状况下22.4 L H2 |
| C、50g硫酸 |
| D、6.02×1023个氨分子 |
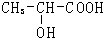
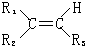
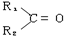 +
+