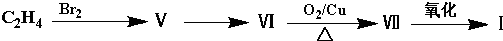题目内容
氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断中错误的是( )
| A、在CCl4中的溶解性BrCl<Br2 |
| B、BrCl氧化性比Br2强,比Cl2弱 |
| C、沸点BrCl>Br2 |
| D、常温下BrCl可与NaOH溶液反应生成NaCl和NaBrO |
考点:卤素原子结构及其性质的比较,氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:A、根据相似形溶原理来回答;
B、卤素单质的氧化性顺序是:氯气>溴单质>碘单质,据此来判断;
C、分子晶体的沸点随着分子量的增大而增大;
D、根据氯气和氢氧化钠之间的反应来回答.
B、卤素单质的氧化性顺序是:氯气>溴单质>碘单质,据此来判断;
C、分子晶体的沸点随着分子量的增大而增大;
D、根据氯气和氢氧化钠之间的反应来回答.
解答:
解:A、卤素单质溴单质和四氯化碳均是非极性分子,但是BrCl不是非极性分子,根据相似形溶原理知道在CCl4中的溶解性BrCl<Br2,故A正确;
B、卤素单质的氧化性顺序是:氯气>溴单质>碘单质,所以BrCl氧化性比Br2强,比Cl2弱,故B正确;
C、分子晶体的沸点随着分子量的增大而增大,所以沸点BrCl<Br2,故C错误;
D、根据氯气和氢氧化钠之间的反应生成氯化钠和次氯酸钠,氯化溴(BrCl)和Br2、Cl2具有相似的性质,常温下BrCl可与NaOH溶液反应生成NaCl和NaBrO,故D正确.
故选C.
B、卤素单质的氧化性顺序是:氯气>溴单质>碘单质,所以BrCl氧化性比Br2强,比Cl2弱,故B正确;
C、分子晶体的沸点随着分子量的增大而增大,所以沸点BrCl<Br2,故C错误;
D、根据氯气和氢氧化钠之间的反应生成氯化钠和次氯酸钠,氯化溴(BrCl)和Br2、Cl2具有相似的性质,常温下BrCl可与NaOH溶液反应生成NaCl和NaBrO,故D正确.
故选C.
点评:本题涉及卤素单质的性质比较以及知识的迁移和应用等方面的知识,注意知识的归纳和梳理是关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏转的是( )
| A、CCl4 |
| B、CH3CH2OH |
| C、CS2 |
| D、苯( C6H6 ) |
“封管实验”具有简易、方便、节约、绿色等优点.观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )


| A、加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B、加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色固体 |
| C、加热时,c中溶液红色变深,冷却后又逐渐变浅 |
| D、水浴时,d内气体颜色加深,e内气体颜色变浅 |
下列说法不正确的是( )
| A、NaClO、NaClO2、KClO3、NaClO4中Cl的化合价依次升高 |
| B、C与CuO高温共热,C的氧化产物只能是CO2 |
| C、H2SO4由分子构成,溶于水离解成H+和SO42- |
| D、Al与Fe2O3高温反应生成Al2O3与Fe,属于置换反应 |
下列离子方程式正确的是( )
| A、NaHSO4与过量的Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+OH-=CO32-+H2O |
| C、碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑ |
| D、硫化钠溶于水中:S2-+2H2O=H2S↑+2OH- |
下表为某有机物分别与各种试剂反应的现象,则这种有机物可能是( )
| 试剂 | 钠 | 酸性高锰酸钾溶液 | NaHCO3溶液 |
| 现象 | 放出气体 | 褪色 | 不反应 |
| A、CH2═CH-COOH |
| B、CH2═CHCH3 |
| C、CH3COOCH2CH3 |
| D、CH2═CHCH2OH |
 如图,在密闭容器中反应:C(s)+H2O(g)?CO(g)+H2(g) (吸热反应)达到平衡后,由于条件的改变而引起正、逆反应速率的变化,及平衡移动状况,则改变的条件是( )
如图,在密闭容器中反应:C(s)+H2O(g)?CO(g)+H2(g) (吸热反应)达到平衡后,由于条件的改变而引起正、逆反应速率的变化,及平衡移动状况,则改变的条件是( )| A、增加CO浓度 | B、增大压强 |
| C、升高温度 | D、增加水蒸气 |