题目内容
甲、乙两位学生分别做淀粉水解产物检验的实验,操作如下:学生甲在一支试管中放入0.5g淀粉后,再加入质量分数为20%的硫酸溶液,加热10min后,再将溶液一分为二,其中一份溶液做银镜反应实验,结果无银镜出现,另一份溶液加入碘水,结果无蓝色出现;学生乙在一支试管中放入0.5g淀粉后,再加入质量分数为20%的硫酸溶液少许,加热45min后,加入过量的NaOH溶液中和硫酸,再将溶液一分为二,其中一份溶液做银镜反应实验,结果有银镜产生,另一份溶液中加入少量碘水,未出现蓝色.
试回答:
(1)学生甲的实验操作不正确的地方是 .
根据甲的实验现象,淀粉的水解情况是 .
A.完全水解; B.部分水解
C.没有水解; D.不能准确判断
(2)学生乙的实验操作不正确的地方是 .
根据乙的实验现象,淀粉的水解情况是 .
A.完全水解;B.部分水解
C.没有水解;D.不能准确判断.
试回答:
(1)学生甲的实验操作不正确的地方是
根据甲的实验现象,淀粉的水解情况是
A.完全水解; B.部分水解
C.没有水解; D.不能准确判断
(2)学生乙的实验操作不正确的地方是
根据乙的实验现象,淀粉的水解情况是
A.完全水解;B.部分水解
C.没有水解;D.不能准确判断.
考点:蔗糖与淀粉的性质实验,淀粉的性质和用途
专题:实验题
分析:(1)银氨溶液在酸性条件下不能存在,检验葡萄糖时溶液要呈碱性;滴加碘水,发现不变蓝色,说明无淀粉;
(2)碘单质在碱性溶液中能发生歧化反应,加入了过量的NaOH溶液,有可能存在I2与NaOH溶液反应;
(2)碘单质在碱性溶液中能发生歧化反应,加入了过量的NaOH溶液,有可能存在I2与NaOH溶液反应;
解答:
解:(1)淀粉水解用稀硫酸催化剂,因为银氨溶液在酸性条件下不能存在,所以学生甲的错误是未加碱来中和硫酸,故不能与葡萄糖作用;水解液中滴加碘水无蓝色现象,说明淀粉已完全水解,
故答案为:未加碱来中和硫酸;A;
(2)学生乙的错误是水解液中加入过量的NaOH溶液,加入碘水之后不变色,有可能是I2与NaOH溶液反应,所以淀粉有可能水解完全也有可能未完全水解,只能说明已经有水解发生,不能准确判断淀粉的水解情况,
故答案为:加入了过量的NaOH溶液;D;
故答案为:未加碱来中和硫酸;A;
(2)学生乙的错误是水解液中加入过量的NaOH溶液,加入碘水之后不变色,有可能是I2与NaOH溶液反应,所以淀粉有可能水解完全也有可能未完全水解,只能说明已经有水解发生,不能准确判断淀粉的水解情况,
故答案为:加入了过量的NaOH溶液;D;
点评:本题考查淀粉的水解和水解产物的检验,题目难度中等,本题旨在测试较高层次的实验评价能力,要求我们不仅要掌握化学实验的基本操作,还能将知识与实验技能有机地结合在一起,并能根据实验现象进行准确分析、评价,从而得出正确结论的能力.

练习册系列答案
相关题目
据美国《科学》杂志报道,外太空的某个星球的大气层中含有大量的CH2=CHOH,此物质常温下为液体,不稳定,易转化为CH3CHO,化学方程式为:CH2=CHOH═CH3CHO+Q (Q>0).据此,以下叙述中不正确的是( )
| A、该星球表面温度很低 |
| B、低温下稳定性:CH2=CHOH<CH3CHO |
| C、常温下CH2=CHOH具有的能量比CH3CHO高 |
| D、高温下稳定性:CH2=CHOH>CH3CHO |
下列物质所对应的化学式不正确的是( )
| A、干冰--CO2 |
| B、硫化亚铁--FeS2 |
| C、苏打--Na2CO3 |
| D、重晶石--BaSO4 |
下列变化中,属于化学变化的是( )
| A、用苯从溴水中萃取溴 |
| B、重油裂化得到轻质燃料油 |
| C、碘的升华 |
| D、石油分馏得到汽油、煤油等产物 |
COCl2(g)?CO(g)+Cl2(g)△H>0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是( )


| A、①表示随温度升高,平衡常数的变化 |
| B、②表示t1时刻加入催化剂,反应速率随时间的变化 |
| C、③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 |
| D、④表示CO的体积分数随充入Cl2量的变化 |
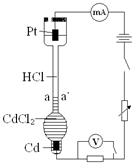 设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )
设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )| A、通电时,H+、Cd2+向Cd电极迁移,Cl-向Pt电极迁移 | ||||
| B、一定时间内,如果通过HCl溶液某一界面的总电量为1.0 C,测得H+所迁移的电量为0.82 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 | ||||
| C、如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 | ||||
D、装置中总反应的化学方程式为:2HCl
|
下列关于电解质溶液中离子浓度关系的说法正确的是( )
| A、0.1mol/L的NaHCO3溶液中离子浓度的关系:c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
| B、0.1mol/L的NH4Cl溶液和0.1mol/L的NH3?H2O等体积混合后离子浓度的关系:c(NH4+)>c( Cl-)>c(OH-)>c(H+) |
| C、常温下,物质的量浓度相等的醋酸溶液与氢氧化钠溶液等体积混合,所得溶液PH=7 |
| D、KHS溶液中存在等式关系:c(S2-)+c(OH-)=c(H+)+c(H2S) |