题目内容
19. 密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:i.CO(g)+2H2(g)?CH3OH(g)△H1=-90.1kJ•mol-1
ii.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
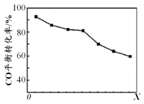
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如图所示.下列说法正确的是( )
| A. | 由H2和CO直接制备二甲醚的反应为放热反应 | |
| B. | 条件X为压强 | |
| C. | X增大,二甲醚的产率一定增大 | |
| D. | X增大,该反应的平衡常数一定减小 |
分析 A.i.CO(g)+2H2(g)?CH3OH(g)△H1=-90.1kJ•mol-1
ii.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
结合盖斯定律计算I×2+ii得到:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-204.7KJ/mol;
B.若X为压强,反应前后气体体积减小,压强增大平衡正向进行;
C.X增大,CO转化率减小,平衡逆向进行;
D.平衡常数随温度变化;
解答 解:A.i.CO(g)+2H2(g)?CH3OH(g)△H1=-90.1kJ•mol-1
ii.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
结合盖斯定律计算I×2+ii得到:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-204.7KJ/mol,反应为放热反应,故A正确;
B.若X为压强,2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)反应前后气体体积减小,压强增大平衡正向进行,CO转化率应增大,图象不符合,故B错误;
C.X增大,CO转化率减小,平衡逆向进行,二甲醚的产率减小,故C错误;
D.X增大,CO转化率减小,平衡可以正向进行,可以是增大CO的量,但平衡常数不变,故D错误;
故选A.
点评 本题考查了热化学方程式计算、影响化学平衡的因素、图象变化的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
14.下列有关物质的性质与用途具有对应关系的是( )
| A. | Al2O3熔点高,可用作耐高温材料 | B. | SiO2能与HF反应,可用作光导纤维 | ||
| C. | KAl(SO4)2易溶于水,可用作净水剂 | D. | Fe2O3能与酸反应,可用作红色涂料 |
4.在无色透明强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Cu2+、NO3-、SO42- | B. | K+、Na+、Cl-、ClO- | ||
| C. | Zn2+、NH4+、NO3-、Cl- | D. | K+、Na+、Ca2+、SO42- |
11.下列热化学方程式正确的是(△H的绝对值均正确)( )
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1(燃烧热) | |
| B. | OH-(aq)+H+(aq)=H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1(反应热) | |
| D. | 2NO2=O2+2NO△H=+116.2 kJ•mol-1(反应热) |
9.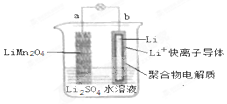 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )| A. | a 为电池的正极 | |
| B. | 电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a 极锂的化合价发生变化 | |
| D. | 放电时,溶液中 Li+从 b 向 a 迁移 |

 .
. .该分子的所有碳原子能否在一个平面上(填“能”或“不能”)不能.
.该分子的所有碳原子能否在一个平面上(填“能”或“不能”)不能.