题目内容
9.如图转化关系,A,B,C,D,E,F含有相同的元素,其中E为淡黄色粉末,据此回答下列问题:
(1)写E→D的化学方程式2Na2O2+4HCl=4NaCl+O2↑+2H2O
(2)写出C→F的离子方程式CO32-+H2O+CO2=2HCO3-
(3)在B→C的变化中,所得C的溶液往往不纯,其中的杂质(不包括水)可能是NaOH,主要原因是CO2不足NaOH剩余,还可能是NaHCO3,主要原因是CO2过量.
分析 A、B、C、D、E均含有钠元素,E为淡黄色粉末,所以E是Na2O2;A→E,所以A是Na;A+H2O→B,所以B是NaOH;B+CO2→C,C+H2O+CO2→F,所以C是 Na2CO3;F是NaHCO3;E+HCl→D,D是 NaCl.所以A、B、C、D、E分别是:Na、NaOH、Na2CO3、NaCl、Na2O2、NaHCO3,结合对应物质的性质以及题目要求解答该题.
解答 解:(1)过氧化钠和盐酸反应生成氯化钠、氧气和水,反应的方程式为2Na2O2+4HCl=4NaCl+O2↑+2H2O,故答案为:2Na2O2+4HCl=4NaCl+O2↑+2H2O;
(2)C是 Na2CO3,F是NaHCO3,C→F的离子方程式为CO32-+H2O+CO2=2HCO3-,故答案为:CO32-+H2O+CO2=2HCO3-;
(3)由2NaOH+CO2=Na2CO3+H2O、NaOH+CO2+H2O=NaHCO3,根据方程式知:反应物是 NaOH和CO2,产生杂质的原因是二氧化碳不足或过量;如果不足,杂质是氢氧化钠,如果过量,杂质是碳酸氢钠,
故答案为:NaOH;CO2不足NaOH剩余;NaHCO3;CO2过量.
点评 本题考查无机物推断,为高考常见题型,侧重考查学生的分析能力,“淡黄色粉末E”是推断突破口,需要学生熟练注意元素化合物知识,难度不大.

练习册系列答案
相关题目
19.古诗词是古人为我们留下的宝贵精神财富. 下列诗句中不涉及氧化还原反应的是( )
| A. | 野火烧不尽,春风吹又生 | B. | 爆竹声中一岁除,春风送暖入屠苏 | ||
| C. | 春蚕到死丝方尽,蜡炬成灰泪始干 | D. | 粉身碎骨浑不怕,要留清白在人间 |
20.下列有关实验原理或实验操作正确的是( )


| A. | 可以用pH试纸测饱和氯水的pH | |
| B. | 用量筒量取8.61 mL 0.1 mol•L-1盐酸 | |
| C. | 用图1所示的操作检查装置的气密性 | |
| D. | 实验室用图2所示的装置制取少量的NO |
17.下列各种酸性氧化物与其对应酸的化学式书写正确的是( )
| A. | SO2→H2SO4 | B. | SO3→H2SO4 | C. | NO2→HNO3 | D. | CO→H2CO3 |
4.下列实验过程的评价,正确的是( )
| A. | 某固体加入稀盐酸,产生了无色气体,证明该固体中一定含有CO32- | |
| B. | 某溶液中滴加BaCl2溶液后,生成不溶于稀HNO3的白色沉淀,该溶液中一定含有SO42- | |
| C. | 某溶液中滴加Ba(OH)2溶液后,生成白色沉淀,该溶液中一定含有SO42- | |
| D. | 要证明烧碱溶液中是否含有氯离子,先加硝酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含有氯离子 |
14.下列关于氧化物分类的说法不正确的组合为( )
①金属氧化物也可以是酸性氧化物;②非金属氧化物一定是酸性氧化物;③碱性氧化物一定是金属氧化物;④能与酸反应生成盐和水的氧化物一定是碱性氧化物;⑤能与碱反应生成盐和水的氧化物一定是酸性氧化物.
①金属氧化物也可以是酸性氧化物;②非金属氧化物一定是酸性氧化物;③碱性氧化物一定是金属氧化物;④能与酸反应生成盐和水的氧化物一定是碱性氧化物;⑤能与碱反应生成盐和水的氧化物一定是酸性氧化物.
| A. | ③④⑤ | B. | ①②③ | C. | ②④⑤ | D. | ①②③④⑤ |
18.下列各项说法正确的是( )
| A. | 白磷应放在冷水中保存 | B. | 将水注入浓硫酸中以稀释浓硫酸 | ||
| C. | 硝酸银放在无色试剂瓶中保存 | D. | 在蒸发皿中加热分解氯酸钾固体 |
19.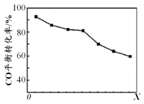 密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)?CH3OH(g)△H1=-90.1kJ•mol-1
ii.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如图所示.下列说法正确的是( )
 密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:i.CO(g)+2H2(g)?CH3OH(g)△H1=-90.1kJ•mol-1
ii.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如图所示.下列说法正确的是( )
| A. | 由H2和CO直接制备二甲醚的反应为放热反应 | |
| B. | 条件X为压强 | |
| C. | X增大,二甲醚的产率一定增大 | |
| D. | X增大,该反应的平衡常数一定减小 |