题目内容
7.关于溶液的酸碱性说法正确的是( )| A. | [H+]很小的溶液一定呈碱性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | [OH-]=[H+]的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
分析 温度未知时要根据溶液中[OH-]、[H+]相对大小判断溶液酸碱性,如果溶液中[OH-]=[H+],则该溶液呈中性,如果溶液中[OH-]>[H+],则该溶液呈碱性,如果溶液中[OH-]<[H+],则溶液呈酸性;常温下pH=7的溶液呈中性,pH<7的溶液呈酸性,pH>7的溶液呈碱性,据此分析解答.
解答 解:A.[H+]很小的溶液不一定呈碱性,可能呈酸性或中性,如常温下[H+]=10-7 mol/L的溶液呈中性,故A错误;
B.pH=7的溶液不一定呈中性,可能呈酸性或碱性,如95℃时中性溶液的pH=6,则该温度下pH=7的溶液呈碱性,故B错误;
C.无论温度高低,[OH-]=[H+]的溶液一定呈中性,故C正确;
D.酚酞试液变色范围为8-10,则不能使酚酞试液变红色的溶液可能呈酸性、中性或碱性,故D错误;
故选C.
点评 本题考查溶液酸碱性判断,为高频考点,要根据溶液中[OH-]、[H+]相对大小判断溶液酸碱性,温度未知时不能根据溶液pH判断溶液酸碱性,题目难度不大.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
6.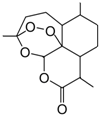 中国女药学家屠呦呦因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖.下列有关青蒿素的叙述错误的是( )
中国女药学家屠呦呦因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖.下列有关青蒿素的叙述错误的是( )
 中国女药学家屠呦呦因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖.下列有关青蒿素的叙述错误的是( )
中国女药学家屠呦呦因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖.下列有关青蒿素的叙述错误的是( )| A. | 青蒿素的同分异构体中不可能含有既苯环有含有羧基 | |
| B. | 易溶于C2H5OC2H5 | |
| C. | 氧原子化合价有-1和-2 | |
| D. | 能与NaOH溶液反应 |
7.某烯烃CH3CH=C(CH3)2是卤代烷消去而生成,则该卤代烷的结构有( )
| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
15.硅被誉为无机非金属材料的主角,下列物品用到硅单质的是( )
| A. | 光电池 | B. | 光导纤维 | C. | 石英钟表 | D. | 陶瓷餐具 |
12.某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的是( )
| A. | 有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 金属钠放入硫酸铜溶液中可以置换出金属铜 | |
| D. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色将表面 |
19.为了说明盐类水解是吸热反应,常温下,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是( )
| A. | CH3COONa溶液中含有少量的CH3COOH | |
| B. | 醋酸钠溶液的pH大于7 | |
| C. | 醋酸钠溶液中滴入酚酞显红色,加热后颜色变深 | |
| D. | 醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气 |
16.下列实验设计能完成或实验结论合理的是( )
| A. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 | |
| B. | 铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含Fe2O3 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| D. | 检验Cu2+和Fe3+离子,采用径向纸层析法,待离子在滤纸上展开后,用浓氨水熏,可以检验出Cu2+ |
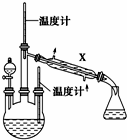 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl