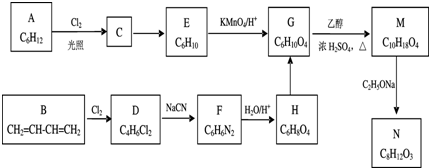
题目内容
12.写出下列反应的化学方程式(1)①乙炔通入过量的溴的四氯化碳溶液:CH≡CH+2Br2→CHBr2-CHBr2;
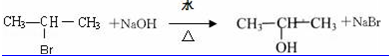
②2-溴丙烷与氢氧化钠水溶液共热:
 ;
;(2)写出2-甲基-3-乙基戊烷的结构简式:
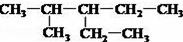 ;
;(3)充分燃烧2.8g某有机物,生成8.8gCO2和3.6gH2O,该有机物蒸气的密度是相同条件下N2的密度2倍.
①该有机物的分子式为:C4H8;
②该有机物所有链状同分异构体的结构简式为:CH2=CHCH2CH3,CH3CH=CH2CH3 ,
 .
.
分析 (1)①乙炔通入过量的溴的四氯化碳溶液,发生加成反应生成1,1,2,2-四溴乙烷;
②2-溴丙烷与氢氧化钠水溶液共热反应生成2-丙醇和溴化钠;
(2)2-甲基-3-乙基戊烷,主链有5个碳原子,2号碳上1个甲基,3号碳上一个乙基;
(3)这种有机物蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,计算2.8g有机物的物质的量,结合生成水和二氧化碳的质量可计算有机物的分子式,并以此确定有机物同分异构体的结构简式.
解答 ①乙炔通入过量的溴的四氯化碳溶液,离子方程式:CH≡CH+2Br2→CHBr2-CHBr2;
故答案为:CH≡CH+2Br2→CHBr2-CHBr2;
②2-溴丙烷与氢氧化钠水溶液共热生成2-丙醇和溴化钠,方程式: ;
;
故答案为 ;
;
(2)2-甲基-3-乙基戊烷,主链有5个碳原子,2号碳上1个甲基,3号碳上一个乙基,2-甲基-3-乙基戊烷的结构简式: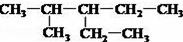 ;
;
故答案为: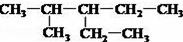 ;
;
(3)①这种有机物蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56;
n(A)=$\frac{2.8g}{2×28g/mol}$=0.05mol,
n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,
n(H)=2n(H2O)=2×$\frac{3.6g}{18g/mol}$=0.4mol,
故有机物分子中含有C原子数目为$\frac{0.2mol}{0.05mol}$=4,含有H原子数目为$\frac{0.4mol}{0.05mol}$=8,
因为12×4+1×8=56=M(A),所以没有O元素;
∴分子式为C4H8,
故答案为:C4H8;
②已知分子式为C4H8,且为链状结构,则分子中有一个C=C,则结构简式为:CH2=CHCH2CH3,CH3CH=CH2CH3 , ,
,
故答案为:CH2=CHCH2CH3,CH3CH=CH2CH3 , .
.
点评 本题考查了化学方程式的书写,侧重有机反应化学方程式顺序,明确有机物结构特点是解题关键,注意根据有机物生成的二氧化碳和水的质量结合相对分子质量判断有机物的分子式,注意有机物的结构特点,题目难度中等.

| A. | CH3CH2OH、NH4HCO3都属于电解质 | |
| B. | 铝热剂、水玻璃、氨水均为混合物 | |
| C. | 铝、铁对应的氧化物均为碱性氧化物 | |
| D. | 溶液和胶体的本质区别是丁达尔效应 |
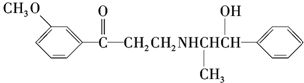
下列关于心酮胺的描述,错误的是( )
| A. | 可以在催化剂作用下和溴发生取代反应 | |
| B. | 可以和银氨溶液发生氧化反应 | |
| C. | 可以和氢溴酸发生取代反应 | |
| D. | 可以和浓硫酸与浓硝酸的混合液发生取代反应 |
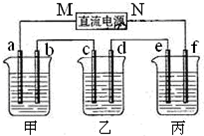
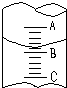 ①图表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为:C
①图表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为:C
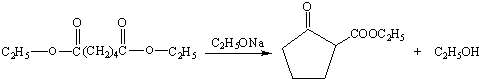
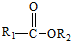 +
+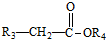 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$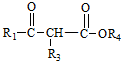 +R2OH
+R2OH .
. .
.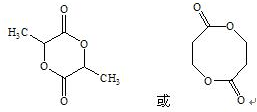 .
.