题目内容
10.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3.关于该物质的说法正确的是( )| A. | 该物质属于盐类 | |
| B. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3mol H+ | |
| D. | 该药剂不适合于胃溃疡患者服用 |
分析 A.该物质可电离出酸根离子和金属阳离子;
B.为纯净物;
C.能与酸反应的为氢氧根和碳酸根离子;
D.该物质与较多的H+反应会产生气体二氧化碳.
解答 解:A.该该物质可电离出酸根离子和金属阳离子,属于盐,故A正确;
B.NaAl(OH)2CO3只有一种物质构成,属于纯净物,故B错误;
C.NaAl(OH)2CO3与盐酸发生反应NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑,由方程式可知1mol该物质最多可消耗4molHCl,即消耗4mol H+,C错误;
D.NaAl(OH)2CO3能与盐酸反应,所以能治疗胃酸过多的胃病患者,但胃溃疡患者不能服用此物,因为产生的CO2对胃有刺激作用,胃溃疡患者会加重,故D正确.
故选AD.
点评 以为双羟基铝碳酸钠载体考查氧化物、氢氧化铝、碳酸钠的性质等,为高频考点,侧重元素化合物知识的综合理解和运用的考查,难度中等,可以根据混合物理解其性质,注意实际为一种盐.

练习册系列答案
相关题目
20.自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展.
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)=2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
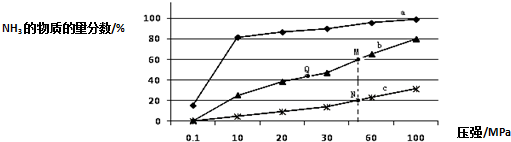
①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
②2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)=2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.

①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
1.下列说法不正确的是( )
| A. | 开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 | |
| B. | 废旧电池不能随意丢弃,要进行深埋处理,防止重金属污染 | |
| C. | “冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 | |
| D. | 人类日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的 |
18.下列实验操作,对实验结果不会产生影响的是( )
| A. | 用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH | |
| B. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| C. | 用酸碱中和滴定法测定未知浓度的碱液时,在锥形瓶中加入2-3mL酚酞试液作指示剂 | |
| D. | 在淀粉溶液中加入稀硫酸加热一段时间后,再滴加银氨溶液检验淀粉的水解产物 |
15.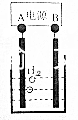 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
已知电解总反应为:2C6H13COONa+2CH3OH$\frac{\underline{\;通电\;}}{\;}$C12H26+2CO2↑+H2↑+2CH3ONa,
下列说法不正确的是( )
 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.已知电解总反应为:2C6H13COONa+2CH3OH$\frac{\underline{\;通电\;}}{\;}$C12H26+2CO2↑+H2↑+2CH3ONa,
下列说法不正确的是( )
| A. | 图中电源的A极为直流电源的负极 | |
| B. | 加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性 | |
| C. | 阳极电极反应为:2C6H13COO--2e-=C12H26+2CO2↑ | |
| D. | 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备 |
1.过氧化铬(CrO5)的结构如右图,由此可推知在CrO5中氧元素的化合价应该是( )
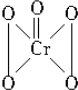

| A. | 全部-1价 | B. | $\frac{4}{5}$为-1价,$\frac{1}{5}$为-2价 | ||
| C. | 全部-2价 | D. | $\frac{4}{5}$为-2价,$\frac{1}{5}$为-1价 |
18.相同体积pH=3的强酸溶液和弱酸溶液分别与足量的镁完全反应,下列说法正确的是( )
| A. | 两者产生等量的氢气 | B. | 强酸溶液产生氢气的速度快 | ||
| C. | 弱酸溶液产生较多的氢气 | D. | 无法比较两者产生氢气的量 |