题目内容
3. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中溶液的颜色从黄色变为橙色时,停止滴定.
(2)图1中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是②,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是偏高(填“偏高”、“偏低”或“无影响”)
(3)图2中是某次滴定时的滴定管中的液面,其读数为23.60mL.
(4)根据下列数据:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 24.10 |
| 第二次 | 20.00 | 3.00 | 27.10 |
分析 (1)测定某NaOH溶液的浓度,用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止;
(2)将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,据此分析判断;如果滴定前有气泡,滴定后气泡消失消耗标准溶液体积增大;
(3)根据滴定管的结构和精确度读取书写,0刻度在上面,精确度0.01ml;
(4)图表中数据计算平均体积=$\frac{24.10-0.2+27.10-3.00}{2}$ml=24ml,氢氧化钠物质的量等于氯化氢物质的量,结合反应定量关系计算烧碱的浓度.
解答 解:(1)测定某NaOH溶液的浓度,用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定.滴定至指示剂刚好变色,由黄色变化为橙色且半分钟内颜色不再改变为止,
故答案为:黄;橙;
(2)图1中,①②为酸式滴定管,③④为碱式滴定管,第②步“调节滴定管的尖嘴部分充满溶液”是调节酸式滴定管,方法正确的是②,如果滴定前有气泡,滴定后气泡消失,消耗标准溶液体积读取数值增大,由此对测定结果形成的影响是 偏高,
故答案为:②; 偏高;
(3)滴定管中的液面读数为23.60mL,故答案为:23.60;
(4)图表中数据计算平均体积=$\frac{24.10-0.2+27.10-3.00}{2}$ml=24ml,氢氧化钠物质的量等于氯化氢物质的量,结合反应定量关系计算烧碱的浓度=$\frac{0.1000mol/L×0.024L}{0.020L}$=0.1200mol/L,
故答案为:0.1200.
点评 本题考查了滴定实验基本操作、滴定管使用方法、滴定实验定量计算等,掌握基础是解题关键,题目难度中等.

 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )| A. | 用溴水可以区分苯、四氯化碳、环己烯 | |
| B. | 苯中的化学键是介于单键与双键之间的化学键,不能发生加成反应 | |
| C. | 苯和溴水在三溴化铁做催化剂下发生取代反应,一定条件下能与氢气发生加成反应 | |
| D. | 苯与硝酸在浓硫酸催化下加热生成硝基苯,苯也能使酸性高锰酸钾溶液褪色 |
| A. | 使用布袋购物、以步代车属于“低碳生活”方式 | |
| B. | 饮用水中矿物质的含量越高越有利于人体健康 | |
| C. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| D. | 采用光触媒技术可将汽车尾气中的NO和CO转化为无毒气体 |
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内质子数多于中子数 |
(1)简述检验Na2SO3已经变质的操作和现象:取少量样品于试管中,加水溶解,先加入过量盐酸,再加入氯化钡溶液,如果有白色沉淀生成,表明Na2SO3已经变质.
(2)另取10.0g试样配成250mL溶液,配制溶液时,可能用到的玻璃仪器有量筒、烧杯、玻璃棒、250 mL容量瓶、胶头滴管.取出25.00mL所配制的Na2SO3溶液于锥形瓶中,用标准酸性KMnO4溶液滴定,采用的指示剂是无(如果不需要,可写“无”).判断滴定实验达到终点的方法是当最后一滴酸性KMnO4溶液滴入锥形瓶后,瓶内溶液变成浅粉红色且半分钟内不褪色.反应的离子方程式为SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平).重复操作四次,消耗0.10mol•L-1 KMnO4溶液的体积如下:
| 编号溶液 | 1 | 2 | 3 | 4 |
| KMnO4(mL) | 20.01 | 19.00 | 19.99 | 20.00 |
| Na2SO3(mL) | 25.00 | 25.00 | 25.00 | 25.00 |
(3)操作时,若未用0.10mol•L-1的酸性KMnO4溶液润洗滴定管,会导致测定结果偏高(填“偏高”、“偏低”或“没有影响”).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是:H2(g)+CO2(g)?CO(g)+H2O(g) | |
| B. | 上述反应的正反应是吸热反应 | |
| C. | 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,如果此时测得CO2为0.5 mol,则该反应达到平衡状态 | |
| D. | 某温度下,如果平衡常数符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时温度700℃ |
| A. | 向溶液中加入5 mL 0.01mol/L NaOH,所得溶液中离子的浓度一定符合:c(Na+)+c(H+)═c(OH-)+c(ClO-) | |
| B. | 25℃时,若溶液的pH=5,则Ka(HClO)=l×10-7 | |
| C. | 向溶液中加入少量NH4Cl固体,溶液中$\frac{c(HClO)}{c(Cl{O}^{-})}$的值变小 | |
| D. | 向溶液中加入10 mL O.01mol/L NaOH,所得溶液中离子浓度的大小顺序为:c(Na+)>c(ClO-)>c(H+)>c(OH-) |
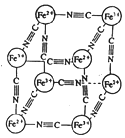 分析化学中常用 X 射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和 Fe3+分别占据立方体的顶点,自身互不相邻,而 CN-位 于立方体的棱上.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用 X 射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和 Fe3+分别占据立方体的顶点,自身互不相邻,而 CN-位 于立方体的棱上.晶体的晶胞结构如图所示,下列说法不正确的是( )| A. | 该晶体中含有共价键,是离子晶体 | |
| B. | M 离子位于晶胞面心,呈+2 价 | |
| C. | M 离子位于晶胞体心,呈+1 价,且 M+空缺率为 50%(体心中没有 M+占总体心的百分比) | |
| D. | 晶体的化学式可表示为 MFe2(CN)6,且 M 为+1 价 |
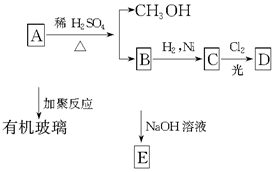
 请回答:
请回答: .
.