题目内容
18.${\;}_{53}^{131}$I是常规核裂变产物之一,可以通过测定大气或水中${\;}_{53}^{131}$I的含量变化来监测核电站是否发生放射性物质泄漏.下列有关${\;}_{53}^{131}$I的叙述中正确的是( )| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内质子数多于中子数 |
分析 根据原子中质子数=核外电子数=原子序数=核电荷数,质量数=质子数+中子数进行分析.
解答 解:A.${\;}_{53}^{131}$I与${\;}_{53}^{127}$I核外电子数相同,质子数相同,最外层电子数相同,化学性质相同,故A正确;
B.原子序数=核电荷数=质子数=53,故B正确;
C.质子数=核外电子数=原子序数=核电荷数,原子核外电子数53,故C错误;
D.原子核内质子数=53,中子数=131-53=78,原子核内质子数少于中子数,故D错误;
故选AB.
点评 本题考查原子结构中质量数与质子数、中子数之间的关系,题目较为简单,注意把握原子的组成.

练习册系列答案
相关题目
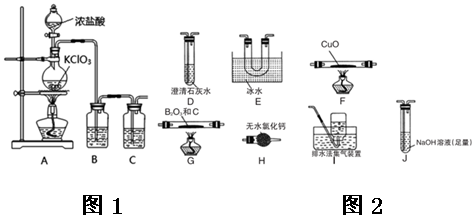
7.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )


| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| D. | 若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中无明显现象 |
8.关于元素周期表,下列叙述中正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在主族元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素 | |
| C. | 在过渡元素区域可以寻找制备新型农药材料的元素 | |
| D. | 非金属性最强的元素在元素周期表的最右上角 |
6.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 室温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| B. | 标准状况下,11.2L CH2Cl2中含有的原子数为2.5NA | |
| C. | 1.68g Fe 与足量高温水蒸气反应,转移电子数为0.09NA | |
| D. | 17g H2O2所含非极性键数目为0.5NA |
13.某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则WgR的气态氢化物中所含电子的物质的量为( )
| A. | $\frac{A}{W+n}$(N-n)mol | B. | $\frac{W}{A+n}$(N+n)mol | C. | $\frac{W}{A+n}$(A-N+n)mol | D. | $\frac{W}{A+n}$(N-A-n)mol |
3. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中溶液的颜色从黄色变为橙色时,停止滴定.
(2)图1中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是②,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是偏高(填“偏高”、“偏低”或“无影响”)
(3)图2中是某次滴定时的滴定管中的液面,其读数为23.60mL.
(4)根据下列数据:
请计算待测烧碱溶液的浓度为0.1200mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中溶液的颜色从黄色变为橙色时,停止滴定.
(2)图1中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是②,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是偏高(填“偏高”、“偏低”或“无影响”)
(3)图2中是某次滴定时的滴定管中的液面,其读数为23.60mL.
(4)根据下列数据:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 24.10 |
| 第二次 | 20.00 | 3.00 | 27.10 |
10.草酸铁晶体Fe2(C2O4)3•xH2O通过相关处理后可溶于水,且能做净水剂,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
步骤1:称量5.20g草酸铁晶体进行处理后,配制成250mL一定物质的量浓度的溶液.
步骤2:取所配溶液25.00mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液至草酸恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+.向反应后的溶液中加入锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤3:用0.0200mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+.
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200mol/LKMnO4溶液为V2、V3mL.
记录数据如下表:
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因Fe3++3H2O?Fe(OH)3(胶体)+3H+(用离子方程式表示).
(2)该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,需用下列仪器中的A、C、D、F(填序号).
A.酸式滴定管 B.碱式滴定管 C.锥形瓶 D.胶头滴管 E.漏斗 F.250mL容量瓶
(3)实验步骤2中 KMnO4氧化草酸的化学方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O;加入锌粉的目的是将Fe3+还原为Fe2+.
(4)步骤3滴定时是否选择指示剂否(是或否);滴定终点的判断方法是加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去.
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有AB.
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
(6)实验测得该晶体中结晶水的个数x为8.
步骤1:称量5.20g草酸铁晶体进行处理后,配制成250mL一定物质的量浓度的溶液.
步骤2:取所配溶液25.00mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液至草酸恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+.向反应后的溶液中加入锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤3:用0.0200mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+.
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200mol/LKMnO4溶液为V2、V3mL.
记录数据如下表:
| 实验编号 | KMnO4溶液的浓(mol/L) | KMnO4溶液滴入的体积(mL) |
| 1 | 0.0200 | V1=20.02 |
| 2 | 0.0200 | V2=23.32 |
| 3 | 0.0200 | V3=19.98 |
(1)草酸铁溶液能做净水剂的原因Fe3++3H2O?Fe(OH)3(胶体)+3H+(用离子方程式表示).
(2)该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,需用下列仪器中的A、C、D、F(填序号).
A.酸式滴定管 B.碱式滴定管 C.锥形瓶 D.胶头滴管 E.漏斗 F.250mL容量瓶
(3)实验步骤2中 KMnO4氧化草酸的化学方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O;加入锌粉的目的是将Fe3+还原为Fe2+.
(4)步骤3滴定时是否选择指示剂否(是或否);滴定终点的判断方法是加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去.
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有AB.
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
(6)实验测得该晶体中结晶水的个数x为8.