题目内容
14.铜及其化合物在工业上有许多用途.回答下列问题:(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
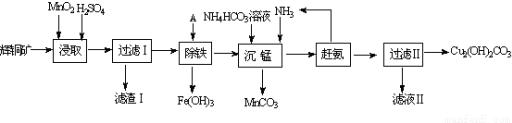
①浸取反应中氧化剂的化学式为MnO2;滤渣Ⅰ的成分为MnO2、S和SiO2(写化学式)
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过2.2 mol/L.(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O.
④滤液Ⅱ经蒸发结晶得到的盐主要是(NH4)2SO4 (写化学式).
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动.
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了0.1mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差0.4g
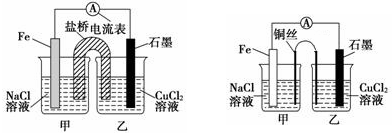
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小.一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH增大(填“减小”、“增大”或“不变”),乙池中石墨为阴极(填“正”、“负”、“阴”或“阳”)
分析 辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜,
(1)①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
②根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据OH-离子的浓度计算Cu2+离子的浓度;
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
④滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体;
(2)①图2为原电池反应,Fe为负极,发生反应:Fe-2e-=Fe2+,石墨为正极,发生反应Cu2++2e-=Cu;根据甲乙两池得失电子相等计算甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量差;
②根他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池.
解答 解:(1)①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2,
故答案为:MnO2;SiO2;
②溶液pH=4,c(OH-)=10-10mol/L,则稀释后的溶液中铜离子浓度最大不能超过:$\frac{2.2×1{0}^{-20}}{(1{0}^{-10})^{2}}$mol/L=2.2 mol/L,
故答案为:2.2;
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O,
故答案为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O;
④滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,
故答案为:(NH4)2SO4;
(2)①图2为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差6g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
6g n
则:n=0.1mol,转移电子的物质的量为0.1mol;
甲池中溶解铁的质量为:$\frac{0.1mol}{2}$×56g/mol=2.8g,溶液质量增加2.8g,乙池中析出铜的质量为:$\frac{0.1mol}{2}$×64g/mol=3.2g,溶液减少3.2g,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差3.2g-2.8g=0.4g,
故答案为:0.1;0.4g;
②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池,Fe是负极,发生:Fe-2e-=Fe2+,Cu丝是正极,正极发生 O2+2H2O+4e-═4OH-,呈碱性,则甲池铜丝附近溶液的pH增大,乙池中与铜线相连石墨电极是阳极,该极上发生的反应式为2Cl--2e-=Cl2↑,与铁丝相连石墨电极是阴极,发生反应:Cu2++2e-=Cu,
故答案为:增大;阴.
点评 本题考查了制备方案的设计,题目难度中等,物质分离提纯的方法和流程分析应用、原电池、电解池的工作原理以及电极反应式的书写和电子守恒的应用知识,为高频考点,属于综合知识的考查,侧重于学生的分析能力和实验能力、电化学原理应用能力的考查,解答该类题目,注意把握实验、反应原理和操作流程的目的,主要是物质性质的理解.

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案| A. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$先增大再减小 | |
| B. | c(NH4+)与c(NH3•H2O)之和始终保持不变 | |
| C. | 水的电离程度始终增大 | |
| D. | 当加入CH3COOH的体积为10mL时,c(NH4+)=c(CH3COO-) |
| A. | 将10 mL该溶液稀释至100 mL后,pH=4 | |
| B. | 向该溶液中加入等体积pH为12的氨水恰好完全中和 | |
| C. | 该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 | |
| D. | 该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
| A. | $\frac{a}{A+m}(Z+m)$mol质子 | B. | $\frac{a}{A}(Z+m)$mol电子 | ||
| C. | $\frac{a}{A+m}(A-Z+m)$mol中子 | D. | $\frac{a}{A}$mmol HmX |
| A. | 常温下将64g铜片投人过量浓硫酸中(铜片) | |
| B. | 向含有0.2molBa(OH)2和O.lmolNaOH的混合溶液中通人标况下3.36LCO2(CO2) | |
| C. | 向lOmL3mol•L-1的盐酸中加人5.6g铁(铁) | |
| D. | 向5.5gMn02粉末中加人20mL2mol•L-1双氧水(Mn02) |
 .
. ⑤
⑤ ⑧
⑧ ⑨
⑨ .
.