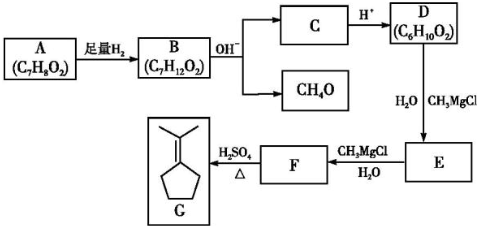
题目内容
把Na2CO3和NaHCO3的混合物29.6g加热到质量不再变化时,得残留固体26.5g.求原混合物中Na2CO3与NaHCO3的物质的量之比.
考点:有关混合物反应的计算
专题:
分析:加热时发生反应方程式为:2NaHCO3
Na2CO3+CO2+H2O,根据题干数据计算出反应前后固体质量的变化,然后根据差量法计算出碳酸氢钠的质量,再计算出碳酸钠的质量,最后根据n=
计算出二者的物质的量之比.
| ||
| m |
| M |
解答:
解:设NaHCO3的物质的量为x,
2NaHCO3
Na2CO3+CO2+H2O△m
2mol 62g
x (29.6-26.5)g=3.1g
x=
=0.1mol,
混合物中碳酸氢钠的质量为:m(NaHCO3)=0.1 mol×84g/mol=8.4g,
混合物中碳酸钠的物质的量为:n(Na2CO3)=
=0.2mol,
所以原混合物中Na2CO3与NaHCO3的物质的量之比为:0.2mol:0.1mol=2:1,
答:原混合物中Na2CO3与NaHCO3的物质的量之比为2:1.
2NaHCO3
| ||
2mol 62g
x (29.6-26.5)g=3.1g
x=
| 2mol×3.1g |
| 62g |
混合物中碳酸氢钠的质量为:m(NaHCO3)=0.1 mol×84g/mol=8.4g,
混合物中碳酸钠的物质的量为:n(Na2CO3)=
| 29.6g-8.4g |
| 106g/mol |
所以原混合物中Na2CO3与NaHCO3的物质的量之比为:0.2mol:0.1mol=2:1,
答:原混合物中Na2CO3与NaHCO3的物质的量之比为2:1.
点评:本题考查了混合物的计算,题目难度中等,注意掌握差量法在化学计算中的应用方法,明确正确书写碳酸氢钠分解的方程式为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在恒温恒容条件下,能使A(g)+2B(s)?C(g)+3D(g)的正反应速率增大的措施是( )
| A、减小C的浓度 |
| B、增大B的量 |
| C、减小D的浓度 |
| D、增大A的量 |
在蒸馏实验中,下列叙述不正确的是( )
A、在蒸馏烧瓶中盛约
| ||
| B、收集蒸馏水时,应弃去开始馏出的部分 | ||
| C、冷水从冷凝管下口入,上口出 | ||
| D、将温度计水银球插入自来水中 |
下列说法正确的是( )
| A、放热反应都是自发的,吸热反应都是非自发的 |
| B、自发反应一定是熵增大,非自发反应一定是熵减少或不变 |
| C、△H<0,△S>0的反应一定是自发反应 |
| D、△H>0,△S>0的反应低温时是自发反应 |