题目内容
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,60g甲醛、乙酸与葡萄糖混合物充分燃烧消耗氧气分子数为3NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1 mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
分析 A、甲醛、乙酸和葡萄糖的最简式均为CH2O;
B、用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则说明阳极上析出的是0.1mol氧气,阴极上析出的是0.1mol铜和0.1mol氢气;
C、反应3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 中实际参与氧化还原反应的水为2mol,失去4mol电子,能将$\frac{4}{3}$molBrF3给还原;
D、Na2SO4和Na2HPO4的摩尔质量均为142g/mol,且均含2个钠离子和1个阴离子.
解答 解:A、甲醛、乙酸和葡萄糖的最简式均为CH2O,故60g混合物中含有的CH2O的物质的量为2mol,而1molCH2O燃烧消耗1mol氧气,故2molCH2O燃烧消耗2mol氧气,即消耗的氧气分子个数为2NA个,故A错误;
B、用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则说明阳极上析出的是0.1mol氧气,阴极上析出的是0.1mol铜和0.1mol氢气,故转移0.4mol电子即0.4NA个,故B错误;
C、反应3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 中实际参与氧化还原反应的水为2mol,失去4mol电子,能将$\frac{4}{3}$molBrF3给还原,即由水还原的BrF3分子数目为$\frac{4}{3}$NA,故C错误;
D、Na2SO4和Na2HPO4的摩尔质量均为142g/mol,故142g混合物的物质的量为1mol,而且两者均含2个钠离子和1个阴离子,故1mol混合物中含离子共3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列分子中,属于含有极性键的非极性分子的一组是( )
| A. | SO2、CCl4 | B. | BF3、CO2 | C. | H2、N2 | D. | NH3、H2O |
20.下列有关物质的分类全部正确的一组是( )
| 非电解质 | 混合物 | 氧化物 | 弱电解质 | |
| A | Cu | 淀粉 | CuO | HClO |
| B | SO3 | 水玻璃 | Na2O•CaO•6SiO2 | H3PO4 |
| C | CH3CH2OH | KAl(SO4)2•12H2O | KClO3 | NH3•H2O |
| D | 葡萄糖 | 普通玻璃 | H2O | H2S |
| A. | A | B. | B | C. | C | D. | D |
10.下列实验装置或操作不符合实验要求的是( )
| A. |  石油分馏 | B. |  灼烧干海带 | C. |  分离汽油和水 | D. |  冶炼金属铁 |
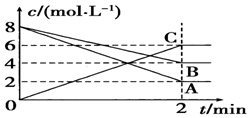 某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得: