题目内容
13.下列分子中,属于含有极性键的非极性分子的一组是( )| A. | SO2、CCl4 | B. | BF3、CO2 | C. | H2、N2 | D. | NH3、H2O |
分析 键的极性只看成键原子是否相同(相同为非极性键,不同为极性键);
分子极性是指正负电荷重心是否重合,具体可以这样判断:如果是双原子分子那么键的极性就决定了分子极性;如果是ABn型就看这些键的极性能否抵消.
解答 解:A.SO2是极性键的极性分子,而CCl4是极性键的非极性分子,故A错误;
B.BF3为极性键的非极性分子,CO2含有O=C,为极性键,二氧化碳是直线分子,呈对称结构,是非极性分子,故B正确;
C.H2、N2含有非极性键,是非极性分子,故C错误;
D.NH3是由极性键构成的极性分子,H2O含有O-H,为极性键,水是V型分子,是极性分子,故D错误,
故选B.
点评 本题考查键的极性和分子的极性的判断,题目难度中等,注意共价键极性和分子极性的判断方法.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
3.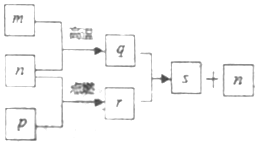 短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 36g物质q与过量的物质r反应则有2mol电子发生转移 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
4.下列事实能用勒夏特列原理解释的是( )
| A. | 使用催化剂,在单位时间内提高合成氨产率 | |
| B. | 对于2HI(g)?H2(g)+2CO(g),达平衡后.缩小容器体积可使体系颇色变深 | |
| C. | 对于2CaO2(s)?2CaO(s)+O2(g),达平衡后增大压强,再次平衡后O2的浓度保持不变 | |
| D. | 溴水中有下列平衡:Br(aq)+H2O(l)?HBr(aq)+HBrO(aq)当加入硝酸银溶液后,溶液颜色变浅 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,60g甲醛、乙酸与葡萄糖混合物充分燃烧消耗氧气分子数为3NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1 mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
2.下列说法正确的是( )
| A. | CO2气体不能支持任何物质的燃烧 | |
| B. | 铝合金的硬度、熔点比组成合金各成分金属的大 | |
| C. | 将一小块钠放入足量AlCl3溶液中,最终有沉淀生成的 | |
| D. | 常温下,金属镁、铝在空气中都能与氧气反应,所以它们在空气中不能稳定存在 |
14.下列实验的设计不合理的是( )
| A. | 在浓氨水中加入生石灰可以制取少量的NH3 | |
| B. | 用水可以一次性鉴别溴苯、苯、乙酸三种物质 | |
| C. | 除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl | |
| D. | 实验室制备乙酸乙酯时,将溶液混合后需用大火迅速加热 |