题目内容
3.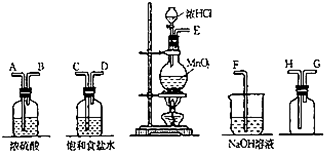 实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:(1)按从左到右的顺序连接仪器,用接口字母按顺序连接为:
E→C→D→A→B→H→G→F.
(2)设计一个简单实验,验证所收集的氯气中是否含有空气用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体.
(3)某同学用2.0mol•L-1的盐酸和漂白粉反应也可以生成氯气,若产生2.24L(标准状况)氯气,发生反应的HCl为0.4mol.
分析 (1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)氯气可与氢氧化钠溶液反应,如含有空气,则与氢氧化钠反应后试管内有残留气体;
(3)依据方程式:4HCl(浓)+Ca(ClO)2=CaCl2+2Cl2↑+2H2O计算解答.
解答 解:(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气,装置连接顺序是:E接C;D接A;B接H;G接F,
故答案为:C;D;A;B;
(2)氯气可与氢氧化钠溶液反应,如含有空气,则与氢氧化钠反应后试管内有残留气体,所以检验方法为:用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体;
故答案为:用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体;
(3)产生2.24L(标准状况)氯气,物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,则
4HCl(浓)+Ca(ClO)2=CaCl2+2Cl2↑+2H2O
4 2
n 0.1mol
n=0.2mol,所以若产生2.24L(标准状况)氯气,发生反应的HCl为0.2mol,
故答案为:0.2.
点评 本题考查了氯气的实验室制备,熟悉制备原理及氯气的性质是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列晶体中,不是分子晶体的是( )
| A. | 氯化铵 | B. | 硫酸 | C. | 氦气 | D. | 三氧化硫 |
8.146C常用于测定古动植物标本的年龄.关于146C原子的说法正确的是( )
| A. | 中子数为6 | B. | 质子数为8 | C. | 核外电子数为14 | D. | 质量数为14 |
15.有A,B两种有机物,可能是烃或烃的含氧衍生物,已知它们含氢的质量分数相等.关于A和B的下列叙述不正确的是( )
| A. | A和B可能是同分异构体 | |
| B. | A和B的最简式可能相同 | |
| C. | A和B不可能一个是烃,一个是烃的含氧衍生物 | |
| D. | 将A和B混合,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧时产生的H2O的量均相等 |
13.关于能量转化的叙述不正确的是( )
| A. | 反应物总能量高于生成物的总能量的反应为放热反应 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 只有氧化还原反应中的化学能才有可能转化为电能---形成原电池 | |
| D. | 需要加热才能发生的反应都是吸热反应 |
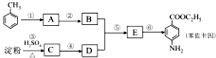 甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
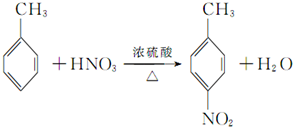 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.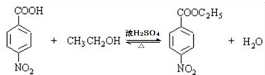 .
. .
.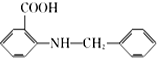 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图: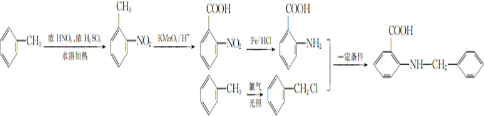 .
.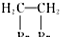
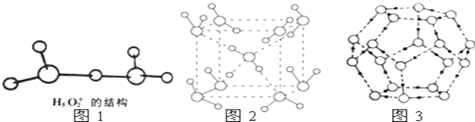
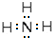 .
. A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.