题目内容
17.现有H2CO3、CH3COOH、H2SO4、H2S四种酸,按照某种分类方法可将H2SO4与其他三种酸分开,这种分类依据是物质的酸性强弱,请再寻找一种分类方法讲上述四种酸中的H2S与其他三种酸分开,这种分类依据是组成中是否含氧.分析 H2CO3、CH3COOH、H2SO4、H2S四种酸,根据物质的酸性强弱分类,再从物质的组成元素分析.
解答 解:H2CO3、CH3COOH、H2SO4、H2S四种酸中,H2CO3、CH3COOH、H2S为弱酸,H2SO4为强酸,所以根据物质的酸性强弱分类,
H2CO3、CH3COOH、H2SO4、H2S四种酸中,H2CO3、H2SO4、CH3COOH为含氧酸,H2S中不含氧元素,
故答案为:物质的酸性强弱;H2S;组成中是否含氧.
点评 本题考查了物质的分类,解答时要分析物质的元素组成和物质的性质,题目难度不大.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
10.下列反应的离子方程式书写正确的是( )
| A. | C12与水反应 C12+H2O═2 H++C1-+ClO- | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 碳酸氢钠溶液与足量盐酸反应:HCO3-+H+═H2O+CO2↑ |
11.下列各组离子,在指定条件下,一定能大量共存的是( )
| A. | 水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、Ba2+、Cl-、NO3- | |
| B. | 使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO- | |
| D. | 在FeCl3溶液中:K+、Na+、SO42-、AlO2- |
2.实验设计是一个学生整体综合能力的考察,下列实验不存在问题的是( )
| 实验项目 | 实验目的 | 实验步骤及现象 |
| A | 比较镁和铝的金属性强弱 | 将镁片和铝片用导线连接后,插入NaOH溶液中,镁片上有气泡冒出 |
| B | CO还原Fe2O3得到的黑色固体中是否有Fe3O4 | 黑色固体中加入盐酸溶解后再加入KSCN溶液,溶液不显红色 |
| C | 比较25℃时K(NH3•H2O)与K(HF)电离常数的大小 | 在25℃时,用pH计测定0.1mol/L的NH4F溶液的pH,pH=6.2 |
| D | 检验气体中是否含有乙烯 | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,紫色消失 |
| A. | A | B. | B | C. | C | D. | D |
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
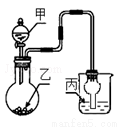
选项 | 液体甲 | 固体乙 | 溶液丙 | 丙中现象 |
A |
| NaHCO3 | 苯酚钠 |
|
B | 浓HCl | KMnO4 | 紫色石蕊 | 最终呈红色 |
C | 浓H2SO4 | Na2SO3 | 品红 | 红色变无色 |
D | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 |
A.A B.B C.C D.D
D.D

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 CH3COOH
CH3COOH CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)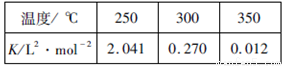

 质的量浓度随时间变化的趋势示意图(其他条件不变,曲
质的量浓度随时间变化的趋势示意图(其他条件不变,曲 线上必须标明氢气、甲醇)。
线上必须标明氢气、甲醇)。 电极反应式________________________。
电极反应式________________________。 为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl
为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl 能与B、C的氢化物形成六配位的配合物,且B、C的氢化物物质
能与B、C的氢化物形成六配位的配合物,且B、C的氢化物物质 的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) 化学方程式是 。
化学方程式是 。