题目内容
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(1)用“双线桥法”标出电子转移的方向和数目 .
(2)浓盐酸在反应中显示出来的性质是 (填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol Cl2,则转移的电子的数目为 ,标况下该反应产生气体体积为
(4)还原剂和还原产物物质的量之比 .
(1)用“双线桥法”标出电子转移的方向和数目
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol Cl2,则转移的电子的数目为
(4)还原剂和还原产物物质的量之比
考点:氧化还原反应的计算,氧化还原反应的电子转移数目计算
专题:
分析:由2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O可知,KClO3中Cl元素的化合价由+5价降低为+4价,HCl中Cl元素的化合价由-1价升高为0,该反应转移2e-,以此来解答.
解答:
解:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,该反应转移2e-,电子转移的方向和数目为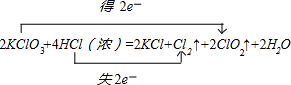 ,故答案为:
,故答案为: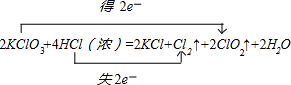 ;
;
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半.
故答案为:②;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子数为0.1mol×2×NA=0.2NA;该反应共生成0.3mol气体,气体标况下的体积为0.3mol×22.4L/mol=6.72L,
故答案为:0.2NA;6.72L;
(4)由反应可知,还原剂为HCl,还原产物为ClO2,2mol还原剂反应生成2mol还原产物,物质的量之比为1:1,故答案为:1:1.
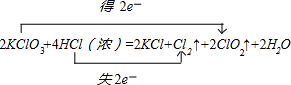 ,故答案为:
,故答案为: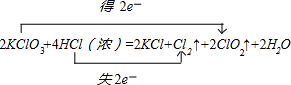 ;
;(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半.
故答案为:②;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子数为0.1mol×2×NA=0.2NA;该反应共生成0.3mol气体,气体标况下的体积为0.3mol×22.4L/mol=6.72L,
故答案为:0.2NA;6.72L;
(4)由反应可知,还原剂为HCl,还原产物为ClO2,2mol还原剂反应生成2mol还原产物,物质的量之比为1:1,故答案为:1:1.
点评:本题考查氧化还原反应的计算,为高频考点,把握元素的化合价变化及电子转移计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
相同温度、相同浓度下的六种电解质溶液,其pH由小到大的顺序如图所示,图中:①②③代表的物质可能分别为( )
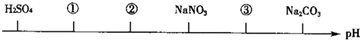
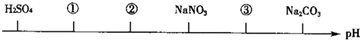
| A、NH4Cl;(NH4)2SO4;CH3COONa |
| B、(NH4)2SO4;NH4Cl;CH3COONa |
| C、(NH4)2SO4;NH4Cl;NaOH |
| D、CH3COOH;NH4Cl;(NH4)2SO4 |
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )| A、此有机物含有如下的官能团:含有碳碳双键、羟基、羰基、羧基 |
| B、1mol该有机物与NaOH 溶液反应,耗2mol.与氢气反应耗氢气5mol |
| C、该有机分子中没有一个有手性碳 |
| D、该有机物不存在顺反异构 |
已知某反应的焓变小于零,则下列叙述正确的是( )
| A、该反应是放热反应 |
| B、该反应是吸热反应 |
| C、该反应中反应物总能量小于生成物总能量 |
| D、无法确定该反应的热效应 |
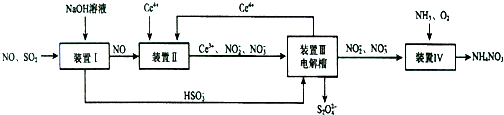
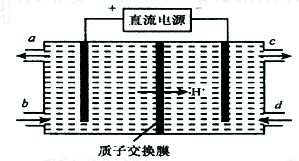
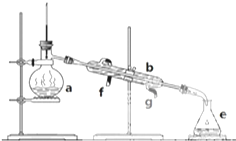 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.