题目内容
16.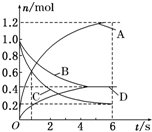 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(C) | |
| C. | 反应进行到6s时,B和D的物质的量浓度均为0.4mol•L-1 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
分析 A.根据图象中的有关数据判断四种物质的变化,再根据计量数之比等于物质的量的变化量之比;
B.根据v=$\frac{\frac{△n}{V}}{△t}$进行计算反应进行到1s时v(A)、v(C);
C.反应进行到6s时,B、D的物质的量都是0.4mol,根据c=$\frac{n}{V}$计算B和D的物质的量浓度;
D.根据v=$\frac{\frac{△n}{V}}{△t}$进行计算反应进行到6s时B的平均反应速率.
解答 解:A.由图可知,反应达到平衡时A物质增加了1.2mol、D物质增加了0.4mol、B物质减少了0.6mol、C物质了0.8mol,所以A、D为生成物,物质的量之比为3:1,B、C为反应物,物质的量之比为3:4,反应方程式为:3B+4C?6A+2D,故A错误;
B.反应到1s时,v(A)=$\frac{\frac{0.6mol}{2L}}{1s}$=0.3mol/(L•s),v(D)=$\frac{\frac{0.2mol}{2L}}{1s}$=0.1mol/(L•s),则v(A)≠v(D),故B错误;
C.反应进行到6s时,B、D的物质的量都是0.4mol,在B、D的物质的量浓度为:$\frac{0.4mol}{2L}$=0.2mol/L,故C错误;
D.反应进行到6s时,v(B)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6mol}{2L}}{6s}$=0.05mol/(L•s),故D正确;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学反应速率、物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
1.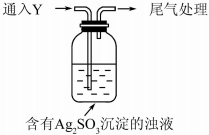 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-,Ag+.
(2)调节pH,实验记录如下:
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为4Ag++2SO32-+O2=2Ag2SO4↓.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是证明不是氧化银.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O═2Ag+H2SO4.
 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-,Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为4Ag++2SO32-+O2=2Ag2SO4↓.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是证明不是氧化银.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O═2Ag+H2SO4.
2.A、B、C、D、E为周期表前20号主族元素,原子半径依次减小,其中A和E同族,A、B原子最外层电子数之比为1:4,A和C能形成一种既含离子键又含非极性共价键的化合物,A与C、B与E原子的电子层数都相差2.下列说法正确的是( )
| A. | D是非金属性最强的元素 | |
| B. | B的单质有多种同分异构体,其中一种是自然界中最坚硬的物质 | |
| C. | B的氢化物的稳定性大于D的氢化物 | |
| D. | A与C只能够形成两种化合物 |
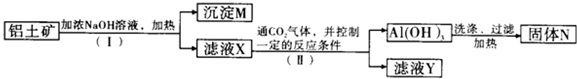
4.高纯度的氢氧化镁广泛应用于医药、电力等领域.镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如下:
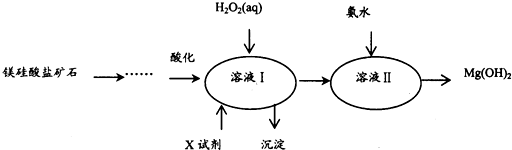
己知1:溶液I中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子
2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
(1)Mg在周期表中的位置第三周期ⅡA族,Si的原子结构示意图为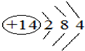 .
.
(2)向溶液I中加入X的作用是调节溶液pH.
(3)向溶液I中加入的两种试剂先后顺序是H2O2、MgO[Mg(OH)2或MgCO3](填化学式).
(4)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
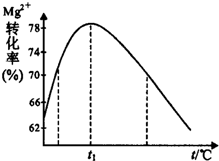
(5)如图是溶液Ⅱ中Mg2+转化率随温度t的变化示意图:
①向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.

己知1:溶液I中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子
2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
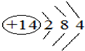 .
.(2)向溶液I中加入X的作用是调节溶液pH.
(3)向溶液I中加入的两种试剂先后顺序是H2O2、MgO[Mg(OH)2或MgCO3](填化学式).
(4)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)如图是溶液Ⅱ中Mg2+转化率随温度t的变化示意图:

①向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
11.某烷烃分子的一氯代物有2种,二氯代物有4种的是( )
| A. | 乙烷 | B. | 丙烷 | ||
| C. | 2-甲基丙烷(CH3)3CH | D. | 2,2-二甲基丙烷(CH3)4C |
1.下列实验能够获得成功的是( )
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |