题目内容
8.工业上用铝土矿(主要成分为Al2O3,还有少量Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: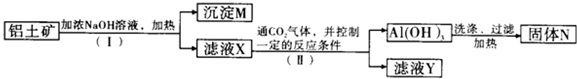
(1)Ⅰ和Ⅱ步骤中分离滤液和沉淀的操作是过滤.
(2)沉淀M中除含有泥沙外,一定还含有Fe2O3;固体N是Al2O3.
(3)滤液X中,含铝元素的溶质的化学式为NaAlO2;它属于盐(填“酸”“碱”或“盐”)类物质.
(4)实验室里常往AlCl3溶液中加入氨水(填“氨水”或“NaOH溶液”)来制取Al(OH)3.发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(5)向滤液Y中滴加足量盐酸,发生的离子反应方程式为2H++SiO32-=H2SiO3↓(若没有反应发生,则填“无”)
分析 Fe2O3和氢氧化钠不反应,而氧化铝、二氧化硅能反应,步骤I利用过滤除去Fe2O3,沉淀M为氧化铁等不溶物,溶液X含有偏铝酸钠、硅酸钠,步骤II通入二氧化碳,控制条件使铝离子转化为氢氧化铝沉淀,过滤得氢氧化铝,加热分解氢氧化铝得到氧化铝,滤液Y主要含有硅酸盐.
(1)分离固体与溶液的方法为过滤;
(2)由工艺流程可知,M为Fe2O3,N为Al2O3;
(3)溶液X含有偏铝酸钠,属于盐;
(4)氢氧化铝溶于强碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与氯化铝反应生成氢氧化铝与氯化铵;
(5)滤液Y主要含有硅酸盐,加入盐酸,生成硅酸沉淀.
解答 解:Fe2O3和氢氧化钠不反应,而氧化铝、二氧化硅能反应,步骤I利用过滤除去Fe2O3,沉淀M为氧化铁等不溶物,溶液X含有偏铝酸钠、硅酸钠,步骤II通入二氧化碳,控制条件使铝离子转化为氢氧化铝沉淀,过滤得氢氧化铝,加热分解氢氧化铝得到氧化铝,滤液Y主要含有硅酸盐.
(1)I和II步骤分离固体与溶液的方法为过滤;
故答案为:过滤;
(2)由工艺流程可知,M为Fe2O3,N为Al2O3;
故答案为:Fe2O3;Al2O3;
(3)由工艺流程可知,滤液X中,含铝元素的溶质的化学式为:NaAlO2,属于盐,
故答案为:NaAlO2;盐;
(4)氢氧化铝溶于强碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与氯化铝反应生成氢氧化铝与氯化铵,反应方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:氨水; Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)滤液Y主要含有硅酸盐,加入盐酸,生成硅酸沉淀,离子方程式为2H++SiO32-=H2SiO3↓,故答案为:2H++SiO32-=H2SiO3↓.
点评 本题以工艺流程题形式考查铝的化合物的性质、物质的分离提纯、化学用语书写等,为高频考点和常见题型,侧重于学生的分析能力和实验能力的考查,题目有利于培养学生良好的科学素养,难度中等,清楚工艺流程原理是关键,是对知识迁移的综合运用.

| a | ||
| c |
| A. | b离子发生水解使溶液呈酸性,c离子发生水解使溶液呈碱性 | |
| B. | 原子半径由小到大的顺序为:d<c<b | |
| C. | a的气态氢化物是造成温室效应的气体之一 | |
| D. | c在氧气中燃烧生成的产物有两种 |
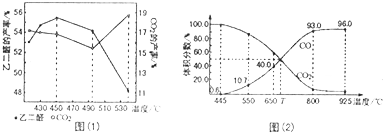
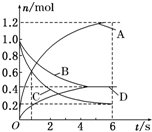 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(C) | |
| C. | 反应进行到6s时,B和D的物质的量浓度均为0.4mol•L-1 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
| A. | 催化剂存在条件下苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 一定条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 光照条件下,乙烷与氯气反应制氯乙烷 |
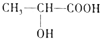 )都是生活中常见的有机物,请按要求完成下列问题;
)都是生活中常见的有机物,请按要求完成下列问题;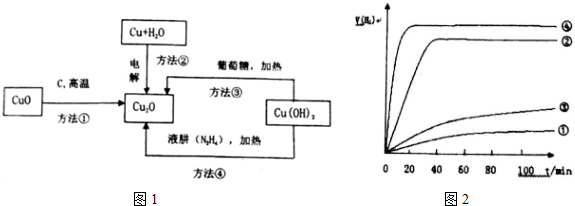
 (制酚醛树脂)④
(制酚醛树脂)④ (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)