题目内容
4.高中化学学习过程中的物质颜色是需要注意的.下列关于颜色的描述正确的个数是( )①氯水放久了会逐渐由黄绿色变成几乎无色
②用硝酸银检验Br-会产生AgBr难溶于水的白色沉淀
③KI溶液中加入淀粉溶液会变成蓝色
④溴水中加入CCl4振荡静置后,上层为橙红色
⑤实验室的浓硝酸溶液久置呈黄色.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①新制氯水中:Cl2+H2O?HCl+HClO,氯水放久了因2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,溶解的Cl2逐渐全部反应最终变成稀盐酸;
②用硝酸银检验Br-会产生AgBr难溶于水的淡黄色沉淀;
③根据能使淀粉溶液变成蓝色的是单质碘;
④溴水中加入CCl4振荡静置后,溴从水中转移到CCl4中,下层为橙红色;
⑤浓硝酸不稳定分解产生二氧化氮溶解在溶液中呈黄色.
解答 解:①新制氯水中:Cl2+H2O?HCl+HClO,氯水放久了因2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,溶解的Cl2逐渐全部反应最终变成稀盐酸,颜色的描述正确;
②用硝酸银检验Br-会产生AgBr难溶于水的淡黄色沉淀,颜色的描述错误;
③根据能使淀粉溶液变成蓝色的是单质碘,而不是碘离子,颜色的描述错误;
④溴水中加入CCl4振荡静置后,溴从水中转移到CCl4中,下层为橙红色,颜色的描述错误;
⑤浓硝酸不稳定分解产生二氧化氮溶解在溶液中呈黄色,颜色的描述正确,所以2个正确,故选B.
点评 本题主要考查了一些常见物质的性质,掌握物质的性质是解题的关键.

练习册系列答案
相关题目
14.含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2.随着SO2的吸收,吸收液的pH不断变化.下列粒子浓度关系一定正确的是( )
| A. | Na2SO3溶液中存在:c (Na+)>c(SO32-)>c (H2SO3)>c (HSO3-) | |
| B. | 已知NaHSO3溶液pH<7,该溶液中:c (Na+)>c (HSO3-)>c (H2SO3)>c (SO32-) | |
| C. | 当吸收液呈酸性时:c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3) | |
| D. | 当吸收液呈中性时:c (Na+)=2 c (SO32-)+c (HSO3-) |
15.断开1mol AB(g)分子中的化学键,使其分解生成气态A原子和气态B原子时所吸收的能量称为A-B键的键能.已在H-H键的键能为436kJ•mol-1,H-N键的键能为391kJ•mol-1,根据热化学方程式N2(g)+3H2(g)═2NH3(g)△H=-92kJ•mol-1,推求N≡N键的键能是( )
| A. | 431 kJ•mol-1 | B. | 946 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 1130 kJ•mol-1 |
12.将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.6mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为( )
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | 1.0mol |
9.浓度为0.05mol•L-1的Na2SO3溶液24mL恰好能被20mL浓度为0.02mol•L-1的K2Cr2O7溶液氧化为Na2SO4,则K2Cr2O7被还原后得到的产物中Cr元素的化合价为( )
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
16.将铜片放入盛有足量稀硫酸的烧杯中,若使铜片溶解,则不能在烧杯中加入( )
| A. | 三氯化铁固体 | B. | 硝酸铵固体 | C. | 稀硝酸溶液 | D. | 硫酸亚铁固体 |
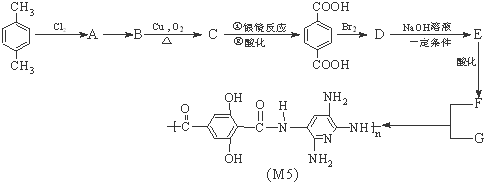
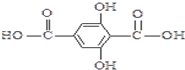 .
.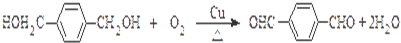 ,
,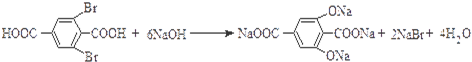 .
.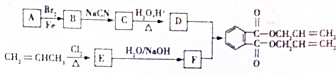
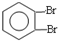 ,化合物E中所含的官能团名称为氯原子、碳碳双键.
,化合物E中所含的官能团名称为氯原子、碳碳双键.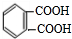 +2HOCH2CH=CH2$\stackrel{催化剂}{→}$
+2HOCH2CH=CH2$\stackrel{催化剂}{→}$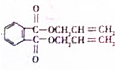 +2H2O,反应类型为酯化(取代)反应.
+2H2O,反应类型为酯化(取代)反应. (其中一种).
(其中一种).