题目内容
14.含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2.随着SO2的吸收,吸收液的pH不断变化.下列粒子浓度关系一定正确的是( )| A. | Na2SO3溶液中存在:c (Na+)>c(SO32-)>c (H2SO3)>c (HSO3-) | |
| B. | 已知NaHSO3溶液pH<7,该溶液中:c (Na+)>c (HSO3-)>c (H2SO3)>c (SO32-) | |
| C. | 当吸收液呈酸性时:c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3) | |
| D. | 当吸收液呈中性时:c (Na+)=2 c (SO32-)+c (HSO3-) |
分析 A.依据亚硫酸钠溶液中亚硫酸根离子分步水解溶液呈碱性,
B.NaHSO3溶液pH<7,该溶液中亚硫酸根离子电离大于水解;
C.依据吸收液呈酸性说明是亚硫酸氢钠溶液或亚硫酸氢钠和亚硫酸分析;
D.依据溶液中电荷守恒分析.
解答 解:A.Na2SO3溶液中存在离子浓度大小c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)>c(H2SO3),故A错误;
B.NaHSO3溶液pH<7,该溶液中亚硫酸根离子电离大于水解,溶液中离子浓度大小c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)>c(H2SO3),故B错误;
C.当吸收液呈酸性时可以是NaHSO3,溶液中存在物料守恒c(Na+)=c(H2SO3)+c(SO32-)+c(HSO3-),可以是NaHSO3和亚硫酸钠混合溶液可能呈酸性,物料守恒不是选项中的物料守恒,故C错误:
D.当吸收液呈中性时,c(H+)=c(OH-),溶液中存在的电荷守恒为c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-)得到c(Na+)=2c(SO32-)+c(HSO3-),故D正确;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较,电荷守恒和物料守恒的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
4.下列叙述正确的是( )
| A. | 镁铝合金的抗腐蚀能力强,不与稀硫酸反应 | |
| B. | Na的金属活动性比Mg的强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 钠可与冷水剧烈反应,而镁与热水才能反应,说明钠比镁活泼 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中,Fe也显+3价 |
2.化学与日常生活密切相关,下列有关说法不正确的是( )
| A. | 过氧化钠作供氧剂 | B. | 葡萄糖酸亚铁可作补铁剂 | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 明矾用作净水剂 |
9.氧化铁是一种红色的颜料,在工业上常以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程如下:
废液$→_{①}^{提纯、结晶}$FeSO4•7HO2$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2CO3
已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
若从硫酸亚铁溶液中结晶出FeSO4•7H2O,控制的温度(t)为t<56.7℃;
(1)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解;
(2)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(3)FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
(4)已知FeSO4•7H2O晶体在加热条件下发生反应,其中一种生成物会用于涂料中的着色剂.请写出
FeSO4•7H2O分解的反应式FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.
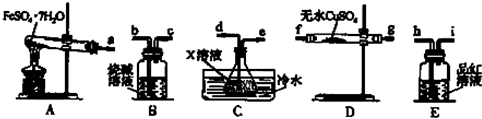
请填写下列空白:
①仪器的连接顺序为a 接f(或g)、g(或f)接d、e接h、i接b;
②装置C中的X为氯化钡溶液.
废液$→_{①}^{提纯、结晶}$FeSO4•7HO2$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2CO3
已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(1)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解;
(2)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(3)FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
(4)已知FeSO4•7H2O晶体在加热条件下发生反应,其中一种生成物会用于涂料中的着色剂.请写出
FeSO4•7H2O分解的反应式FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.

请填写下列空白:
①仪器的连接顺序为a 接f(或g)、g(或f)接d、e接h、i接b;
②装置C中的X为氯化钡溶液.
19.对下列现象或反应事实的解释正确的是( )
| 选项 | 现象或反应事实 | 解释 |
| A | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝的熔点比铝高 |
| B | 工业合成氨反应需在高温条件下进行 | 提高氨的产率 |
| C | 镀层破损后,镀锡的铁比镀锌的铁易腐蚀 | 锡比锌活泼 |
| D | 2CO═2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A. | A | B. | B | C. | C | D. | D |
6.下列各组离子,可以形成无色透明碱性溶液的是( )
| A. | K+、NH4+、OH-、NO3- | B. | Mg2+、Na+、AlO2-、OH- | ||
| C. | Na+、Ba2+、OH-、SO42- | D. | Cu2+、Al3+、SO42-、Cl- |
3.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 明矾净水的原理和家用消毒液消毒的原理相同 | |
| B. | 在食品中科学使用食品添加剂,有利于提高人类生活质量 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放 |
 $\stackrel{O_{2}/Cu}{→}$不能被氧化
$\stackrel{O_{2}/Cu}{→}$不能被氧化
 .
. 、
、 、
、 、
、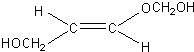 .
.