题目内容
3.下列说法正确的是( )| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | ${K_{a_1}}$=1.54×10-2 |
| ${K_{a_2}}$=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 1mol•L-1NaHA溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH变大 | |
| D. | 已知某温度下常见弱酸的电离平衡常数如表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 |
分析 A、NaHA可能为强酸的酸式盐,溶液中可能不存在H2A;
B、根据电荷守恒c(Na+)+c(H+)>c(OH-)+c(CH3COO-),溶液为酸性,故氢离子浓度大于氢氧根离子浓度,故c(Na+)<c(CH3COO;
C、缓冲体系中溶液pH值保持恒定;
D、相同温度下,酸的强弱酸性是:H2SO3>HF>CH3COOH>HSO3-,酸根离子水解程度大小顺序是:HSO3-<F-<CH3COO-<SO32-.
解答 解:A、NaHA可能为强酸的酸式盐,溶液中可能不存在H2A,故A错误;
B、根据电荷守恒c(Na+)+c(H+)>c(OH-)+c(CH3COO-),溶液为酸性,故氢离子浓度大于氢氧根离子浓度,故c(Na+)<c(CH3COO-),故B错误;
C、缓冲体系中溶液pH值保持恒定,故C错误;
D、相同温度下,酸的强弱酸性是:H2SO3>HF>CH3COOH>HSO3-,酸根离子水解程度大小顺序是:HSO3-<F-<CH3COO-<SO32-,相同浓度的钠盐溶液中,酸根离子水解程度越大其溶液的离子总数相应变大,所以相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3,故D正确.
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较方法,溶液中电荷守恒的分析判断,溶液中离子的特征性质和水解、电离,是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.汽车尾气中的CO、NOX是大气的主要污染物,人们尝试使用稀土制成的催化剂将CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ•mol-1
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂对上述转化反应的作用,用气体传感器测得不同时间的NO和CO浓度如下:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2)=1.875×10-4mol/L.s.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
(3)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时分别发生以下反应:
18NO(g)+2C3H6(g)?9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g)?9N2(g)+12CO2(g)+12H2O(g);
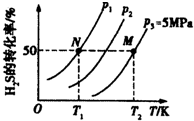
并分别测定各温度下经相同时间时的NOx转化率,绘得图象如图1所示:
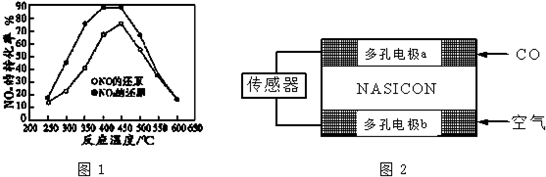
①分析图中信息可以得出的结论是
结论一:由NOX转化率数据可判断,相同温度下NO的转化率比NO2低(填“高”或“低”)
结论二:在250°C~450°C时,NOx转化率随温度升高而增大,450°C~600°时NOx转化率随温度升高而减小或两反应为放热反应
②在上述NO2和C3H6的反应中,能提高NO2转化率的措施有BC.(填序号)
A.加入催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
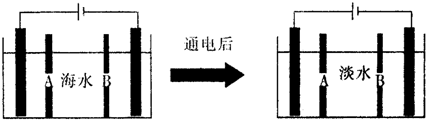
(4)CO分析仪以燃料电池为工作原理,其装置如图2所示.该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.工作时多孔电极a的电极反应方程式为CO+O2--2e-=CO2.
.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ•mol-1
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂对上述转化反应的作用,用气体传感器测得不同时间的NO和CO浓度如下:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol•L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v (N2)=1.875×10-4mol/L.s.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
(3)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时分别发生以下反应:
18NO(g)+2C3H6(g)?9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g)?9N2(g)+12CO2(g)+12H2O(g);
并分别测定各温度下经相同时间时的NOx转化率,绘得图象如图1所示:

①分析图中信息可以得出的结论是
结论一:由NOX转化率数据可判断,相同温度下NO的转化率比NO2低(填“高”或“低”)
结论二:在250°C~450°C时,NOx转化率随温度升高而增大,450°C~600°时NOx转化率随温度升高而减小或两反应为放热反应
②在上述NO2和C3H6的反应中,能提高NO2转化率的措施有BC.(填序号)
A.加入催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
(4)CO分析仪以燃料电池为工作原理,其装置如图2所示.该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.工作时多孔电极a的电极反应方程式为CO+O2--2e-=CO2.
.
14.人类生活离不开化学知识,下列叙述正确的是( )
| A. | 双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 | |
| B. | 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理 | |
| C. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
11.海水资源的开发与利用具有广阔的前景,海水的pH一般在7.5~8.6之间.某地海水中主要离子的含量如表:
(1)海水显弱碱性的原因是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-,该海水中Ca2+的物质的量浓度为4×10-3 mol/L.
(2)下面是海水利用电渗析法获得淡水的原理图,电极为惰性电极.请分析下列问题:
①阳离子交换膜是指B(填A或B).
②写出通电后阳极区的电极反应式:2Cl--2e-=Cl2↑.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
(3)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将水中悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;离子交换法是软化水的常用方法,聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式CH2=CHCOONa.
(4)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收80g Br2时转移的电子为$\frac{5}{6}$mol.
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(2)下面是海水利用电渗析法获得淡水的原理图,电极为惰性电极.请分析下列问题:

①阳离子交换膜是指B(填A或B).
②写出通电后阳极区的电极反应式:2Cl--2e-=Cl2↑.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
(3)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将水中悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;离子交换法是软化水的常用方法,聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式CH2=CHCOONa.
(4)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收80g Br2时转移的电子为$\frac{5}{6}$mol.
8.氮可形成多种化合物,如NH3、NO2、N2O4等气体.已知NO2和N2O4的结构式分别是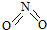 和
和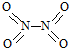 .已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
.已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)=2NO2(g)△H=+57kJ•mol-1.
(2)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①上述条件下,从反应开始直至20s时,NO2的平均反应速率为0.0025mol•L-1•s-1.
②n3=n4(填“>”、“<”或“=”),反应2NO2?N2O4的平衡常数K的数值为2.8(精确到小数点后两位),升高温度后,该反应的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料.电池的总反应为4NH3(g)+3O2(g)=2N2(g)+6H2O(g),则该燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
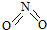 和
和 .已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
.已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)=2NO2(g)△H=+57kJ•mol-1.
(2)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
②n3=n4(填“>”、“<”或“=”),反应2NO2?N2O4的平衡常数K的数值为2.8(精确到小数点后两位),升高温度后,该反应的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料.电池的总反应为4NH3(g)+3O2(g)=2N2(g)+6H2O(g),则该燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
12.下列物质中属于高分子化合物的是( )
①淀粉 ②纤维素 ③油脂 ④蔗糖 ③聚乙烯.
①淀粉 ②纤维素 ③油脂 ④蔗糖 ③聚乙烯.
| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | 全部 |
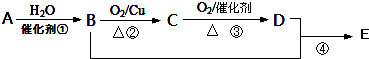
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
 .
.