题目内容
2.不属于定量仪器的是( )| A. | 滴定管 | B. | 量筒 | C. | 电子天平 | D. | 烧杯 |
分析 选项中只有烧杯中不属于定量仪器,可用于接收液体、溶液配制时溶解和稀释使用,以此来解答.
解答 解:A.滴定管为定量仪器,可定量取用液体,为中和滴定的必要仪器,故A不选;
B.量筒为定量仪器,可量取一定体积的液体,故B不选;
C.电子天平为定量仪器,可称量一定质量的固体,故C不选;
D.烧杯不属于定量仪器,故D选;
故选D.
点评 本题考查仪器的使用,为高频考点,把握常见的定量仪器为解答的关键,侧重分析与实验能力的考查,注意仪器的结构及使用方法,题目难度不大.

练习册系列答案
相关题目
12.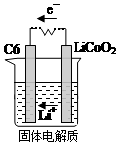 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )| A. | 阴极 | B. | 阳极 | C. | 负极 | D. | 正极 |
10.下列反应中硫酸既表现氧化性,又表现出酸性的是( )
| A. | 实验室用浓硫酸干燥氯气、氯化氢等气体 | |
| B. | 将KI与浓硫酸混合,有紫色蒸气产生 | |
| C. | 浓硫酸与氧化铁反应,生成硫酸铁 | |
| D. | 用浓硫酸在木制品上“烙”字画 |
17. 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)=2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
7.等质量的铝分别投入等物质的量浓度等体积的盐酸和氢氧化钠溶液中,充分反应后下列情况不可能出现的是( )
| A. | 金属铝均剩余 | |
| B. | 金属铝均溶解 | |
| C. | 盐酸中铝剩余,而氢氧化钠中铝全部溶解 | |
| D. | 氢氧化钠这铝剩余,而盐酸中铝全部溶解 |
6.(1)某学习小组通过实验研究Na2O2与水的反应.
①Na2O2的电子式为 ,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
②甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
(2)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
由此可以推断:
溶液中肯定存在的离子有H+、NH4+、Ba2+、I-.溶液中不能确定是否存在的离子有K+、Cl-.
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 ,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.②甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
(2)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
由此可以推断:
溶液中肯定存在的离子有H+、NH4+、Ba2+、I-.溶液中不能确定是否存在的离子有K+、Cl-.
4.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
| A. | lmolKClO3参加反应生成气体的体积为22.4L(标况下) | |
| B. | 该反应的还原产物为CO2 | |
| C. | 0.5mol H2C2O4参加反应有lmol电子转移 | |
| D. | H2SO4在反应中是氧化剂 |

 .
.