题目内容
8.下表是元素周期表的一部分,回答相关的问题| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ |
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:2K+2H2O=2K ++2OH-+H2↑.
(3)在这些元素中,最高价氧化物的水化物酸性最强的是HClO4(填相应化学式,下同),碱性最强的是KOH.
(4)这些元素中(除⑨外),原子半径最小的是F(填元素符号,下同),原子半径最大的是K.
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2,(O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)2F2+2OH-=OF2+2F-+H2O.
(6)⑦的低价氧化物通入足量Ba(NO3)2溶液中的离子方程式:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+.
分析 (1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar,⑩为K,⑪为Br;
(2)最活泼的金属为K,与水反应生成氢氧化钾与氢气;
(3)最高价氧化物的水化物酸性最强的是高氯酸,碱性最强的是氢氧化钾;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(5)F2与氢氧化钠反应生成OF2,由电荷守恒可知生成NaF,同时生成水;
(6)二氧化硫通入硝酸钡溶液中,酸性条件下硝酸根具有强氧化性,反应生成硫酸钡沉淀与NO.
解答 解:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar,⑩为K,⑪为Br,
故答案为:Mg;
(2)最活泼的金属为K,与水反应生成氢氧化钾与氢气,反应离子方程式为:2K+2H2O=2K ++2OH-+H2↑,
故答案为:2K+2H2O=2K ++2OH-+H2↑;
(3)最高价氧化物的水化物酸性最强的是HClO4,K的金属性最强,故碱性最强的是KOH,
故答案为:HClO4;KOH;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故F原子半径最小,K原子半径最大,
故答案为:F;K;
(5)F2与氢氧化钠反应生成OF2,由电荷守恒可知生成NaF,同时生成水,反应方程式为:2F2+2OH-=OF2+2F-+H2O,
故答案为:2F2+2OH-=OF2+2F-+H2O;
(6)二氧化硫通入硝酸钡溶液中,酸性条件下硝酸根具有强氧化性,反应生成硫酸钡沉淀与NO,反应离子方程式为:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+.
点评 本题考查元素周期表与元素周期律综合运用,熟练掌握周期表的结构,侧重常用化学用语、元素周期律以及学生分析解决问题的能力的考查.

| A. | CH3CH═CH(OH2)2CH3 | B. | CH2═CH(CH2)2CH3 | ||
| C. | CH3CH═CH-CH═CHCH3 | D. | CH3CH2═CHCH2CH3 |
| A. | H2O2分子中含有极性键和非极性键 | |
| B. | 向其溶液加入少量MnO2和FeCl3等能加快反应 | |
| C. | H2O2分子中所有原子都达8电子结构 | |
| D. | 该反应中H2O2是氧化剂也是还原剂 |
| A. | 不粘锅的原料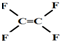 为烃类化合物 为烃类化合物 | |
| B. | 分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 | |
| C. | 石油分馏是物理变化,煤的气化、液化是化学变化 | |
| D. | 油脂在酸性或碱性条件下都能发生水解反应制取肥皂 |
| A. | NO3-、OH-、Na+ | B. | Fe2+、OH-、NO3- | C. | Fe2+、H+、Cl- | D. | Fe2+、H+、NO3- |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
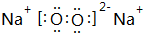
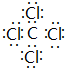 .
.(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2 Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式
 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号). | A. | C21H33COOC2H5 | B. | C21H31COOC2H5 | C. | C22H33COOC2H5 | D. | C22H39COOC2H5 |
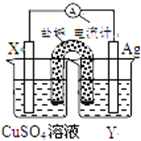 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.