题目内容
下列事实不能用勒沙特列原理解释的是( )
| A、用排饱和氯化钠溶液的方法收集氯气 |
| B、加催化剂,在一定条件下使N2和H2转化为NH3 |
| C、加压有利于SO2与O2反应生成SO3 |
| D、可用浓氨水和氢氧化钠固体来快速制取氨气 |
考点:化学平衡移动原理
专题:化学平衡专题
分析:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答:
解:A.氯气和水的反应中存在平衡Cl2+H2O?H++Cl-+HClO,饱和食盐水中含有氯离子,能抑制氯气和水反应,所以能用平衡移动原理解释,故A不选;
B.催化剂只能改变反应速率不影响平衡移动,所以不能用平衡移动原理解释,故B选;
C.二氧化硫和氧气反应中存在平衡2SO2+O2
2SO3,增大压强平衡向气体体积减小的方向正反应方向移动,所以能用平衡移动原理解释,故C不选;
D.一水合氨中存在平衡NH3.H2O?NH3↑+H2O,且该反应是吸热反应,向浓氨水中加入NaOH固体,氢氧化钠溶解放出热量促进一水合氨分解,所以可以用化学平衡移动原理解释,故D不选;
故选B.
B.催化剂只能改变反应速率不影响平衡移动,所以不能用平衡移动原理解释,故B选;
C.二氧化硫和氧气反应中存在平衡2SO2+O2
| 催化剂 |
| △ |
D.一水合氨中存在平衡NH3.H2O?NH3↑+H2O,且该反应是吸热反应,向浓氨水中加入NaOH固体,氢氧化钠溶解放出热量促进一水合氨分解,所以可以用化学平衡移动原理解释,故D不选;
故选B.
点评:本题考查化学平衡移动原理,化学平衡移动原理适用于所有可逆反应,注意催化剂不能改变平衡移动,只能影响反应速率,为易错点.

练习册系列答案
相关题目
下列试剂的保存方法正确的是( )
| A、NaOH溶液保存在配有玻璃塞的细口瓶中 |
| B、金属钠通常密封保存在煤油中 |
| C、氯水保存在无色透明的试剂瓶中 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
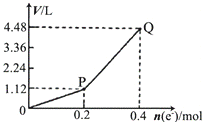 用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )
用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )| A、电解过程中,溶液的pH不断增大 |
| B、当转移0.4mol e-时,电解生成的铜为6.4g |
| C、阳极电极反应式为2H2O+4e-=4H++O2↑ |
| D、Q点对应的气体中,H2与O2的体积比为2:1 |
下列金属冶炼的反应原理,错误的是( )
A、2NaCl(水溶液)
| ||
B、CuO+H2
| ||
C、Fe3O4+4CO
| ||
D、2HgO
|
PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,下列有关PM2.5说法不正确的是( )
| A、PM2.5表面积大能吸附大量的有毒、有害物质 |
| B、PM2.5在空气中形成气溶胶 |
| C、实施绿化工程,可以有效地防治PM2.5污染 |
| D、研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
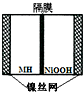 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池 (MH-Ni碱性电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池 (MH-Ni碱性电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- |
| B、放电时负极反应为:MH+OH--2e-=H2O+M+ |
| C、充电时氢氧根离子移向阳极,要参与电极反应 |
| D、充电时电池的正极连接直流电源的正极,得到电子发生还原反应 |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、4.6g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、标准状况下,1.12LCCl4含有C-Cl键的数目为0.2NA |
| D、将0.1mol FeCl3溶于 1L水中,所得溶液中含有0.1NA个Fe3+ |
 实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)求:
实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)求: