题目内容
化学是一门以实验为基础的自然科学.掌握实验方法以及完成化学实验所需要的技能,是学好化学的关键.
(1)正确使用仪器、按正确的步骤进行实验都是实验成功的关键.请回答:
①分液时,分液漏斗中的液体很难滴下,原因是: .
②容量瓶使用之前,必须进行的操作为: .
③可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先 .
(2)在化学实验中常常要用到溶液,准确配制一定物质的量浓度的溶液,也是一种很基本的实验操作.实验室需要480mL 0.1mol?L-1NaOH溶液,根据溶液配制情况回答下列问题:
①实验中除了托盘天平、量筒、烧杯、容量瓶、药匙外,还需要的其他仪器有: .
②根据计算得知,所需NaOH的质量为 g.
③NaOH固体溶解后未冷至室温即进行转移、定容,会导致所得溶液浓度 .(填“偏高”、“偏低”或“无影响”)
(3)氯气是化学实验中常用的一种氧化剂.
①实验室制备氯气的化学方程式是 .
②多余的氯气应及时地进行吸收处理,以防污染空气.实验室制备氯气实验中的尾气处理的反应方程式是 .
(1)正确使用仪器、按正确的步骤进行实验都是实验成功的关键.请回答:
①分液时,分液漏斗中的液体很难滴下,原因是:
②容量瓶使用之前,必须进行的操作为:
③可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先
(2)在化学实验中常常要用到溶液,准确配制一定物质的量浓度的溶液,也是一种很基本的实验操作.实验室需要480mL 0.1mol?L-1NaOH溶液,根据溶液配制情况回答下列问题:
①实验中除了托盘天平、量筒、烧杯、容量瓶、药匙外,还需要的其他仪器有:
②根据计算得知,所需NaOH的质量为
③NaOH固体溶解后未冷至室温即进行转移、定容,会导致所得溶液浓度
(3)氯气是化学实验中常用的一种氧化剂.
①实验室制备氯气的化学方程式是
②多余的氯气应及时地进行吸收处理,以防污染空气.实验室制备氯气实验中的尾气处理的反应方程式是
考点:过滤、分离与注入溶液的仪器,配制一定物质的量浓度的溶液
专题:实验题
分析:(1)①使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
②容量瓶使用之前,必须进行检漏,防止配制溶液时有液体漏出;
③可燃性气体与氧气混合达到一定程度时遇明火会发生爆炸,所以可燃性气体点燃前必须检验气体的纯度,否则可能发生爆炸.
(2)①根据配制溶液的操作步骤选择所用仪器;
②配制480mL溶液,需要选用500mL容量瓶,根据n=cV计算出500mL 0.10mol/LNaOH溶液中含有的氢氧化钠的物质的量,再根据m=nM计算出需要氢氧化钠的质量;
③根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(3)①实验室制备氯气的化学方程式是:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
②氯气水溶液呈酸性,可以用碱性物质进行吸收处理.
②容量瓶使用之前,必须进行检漏,防止配制溶液时有液体漏出;
③可燃性气体与氧气混合达到一定程度时遇明火会发生爆炸,所以可燃性气体点燃前必须检验气体的纯度,否则可能发生爆炸.
(2)①根据配制溶液的操作步骤选择所用仪器;
②配制480mL溶液,需要选用500mL容量瓶,根据n=cV计算出500mL 0.10mol/LNaOH溶液中含有的氢氧化钠的物质的量,再根据m=nM计算出需要氢氧化钠的质量;
③根据c=
| n |
| v |
(3)①实验室制备氯气的化学方程式是:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
②氯气水溶液呈酸性,可以用碱性物质进行吸收处理.
解答:
解:(1)①使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开分液漏斗,发现其中的液体不能流下,可能的原因是分液漏斗瓶塞未打开(或玻璃塞上的凹槽没有与漏斗上的小孔对齐);
②容量瓶使用之前,必须检验容量瓶是否漏水.
③可燃性气体与氧气混合达到一定程度时遇明火会发生爆炸,所以可燃性气体点燃前必须检验气体的纯度,否则可能发生爆炸.
故答案为:①没有打开分液漏斗颈上的玻璃塞(或玻璃塞上的凹槽没有与漏斗上的小孔对齐);
②检验容量瓶是否漏水;
③检验气体纯度.
(2)①在溶解氢氧化钠固体时要用玻璃棒搅拌加速溶解,转移液体时引流,在定容时要用胶头滴管定容,
②500mL 0.10mol/LNaOH溶液中含有氢氧化钠的物质的量n=cv=0.1mol/L×0.5L=0.05mol,需要氢氧化钠的质量m=nM=0.05mol×40g/mol=2.0g,
③根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,NaOH固体溶解后未冷至室温即进行转移、定容,使得配制所用蒸馏水减少,即溶液的体积V减小,故所得溶液浓度偏高.
故答案为:①玻璃棒、胶头滴管; ②2.0; ③偏高;
(3)①实验室制备氯气的化学方程式是:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;
②氯气水溶液呈酸性,可以用碱性物质NaOH进行吸收处理.发生的反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:①;MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;②2NaOH+Cl2=NaCl+NaClO+H2O.
②容量瓶使用之前,必须检验容量瓶是否漏水.
③可燃性气体与氧气混合达到一定程度时遇明火会发生爆炸,所以可燃性气体点燃前必须检验气体的纯度,否则可能发生爆炸.
故答案为:①没有打开分液漏斗颈上的玻璃塞(或玻璃塞上的凹槽没有与漏斗上的小孔对齐);
②检验容量瓶是否漏水;
③检验气体纯度.
(2)①在溶解氢氧化钠固体时要用玻璃棒搅拌加速溶解,转移液体时引流,在定容时要用胶头滴管定容,
②500mL 0.10mol/LNaOH溶液中含有氢氧化钠的物质的量n=cv=0.1mol/L×0.5L=0.05mol,需要氢氧化钠的质量m=nM=0.05mol×40g/mol=2.0g,
③根据c=
| n |
| v |
故答案为:①玻璃棒、胶头滴管; ②2.0; ③偏高;
(3)①实验室制备氯气的化学方程式是:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;
②氯气水溶液呈酸性,可以用碱性物质NaOH进行吸收处理.发生的反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:①;MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;②2NaOH+Cl2=NaCl+NaClO+H2O.
点评:本题考查了常用仪器的使用方法和一定物质的量浓度溶液的配制,题目难度中等,要求学生掌握配制一定物质的量浓度溶液的正确操作方法,本题难点在于误差分析,注意掌握误差分析方法与技巧.

练习册系列答案
相关题目
重水(D2O)是重要的核工业原料,下列说法错误的是( )
| A、重水是原子反应堆的导热剂 |
| B、氘(D)原子核内有1个中子 |
| C、H2O与D2O的物理性质不相同 |
| D、1H、D与16O、18O形成的水分子,其相对分子质量不相同的有5种 |
下列说法不正确的是( )
| A、15.6gNa2O2与过量CO2反应时,转移的电子数为0.2NA |
| B、0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.02NA |
| C、7.1gCl2与足量Ca(OH)2反应时转移的电子总数为0.2NA |
| D、1.7gNH3中含有的质子数为NA |
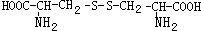
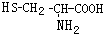 ,则下列说法错误的是
,则下列说法错误的是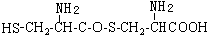
 可与NaOH溶液反应放出一种碱性气体.
可与NaOH溶液反应放出一种碱性气体.
 现有可逆反应:mA(g)+nB(g)?pC(g)+qD(g);根据如图示回答:
现有可逆反应:mA(g)+nB(g)?pC(g)+qD(g);根据如图示回答: