题目内容
氯是重要的非金属元素.
(1)NaCl和浓硫酸微热制取氯化氢的化学方程式为 ;可用 试纸放在瓶口以检验氯化氢气体是否集满.
(2)新制氯水中含有的分子有:Cl2、H2O和 ;光照新制氯水的化学方程式为 ;工业是用电解食盐水制取氯气,阴极的电极反应式为:2H++2e→H2↑,则阳极的电极反应式为 .
(3)已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 (选填编号).
a.NaCl Na2SO4 b.NaCl NaBr Na2SO4
c.NaCl Na2SO4 I2 d.NaCl NaI Na2SO4.
(1)NaCl和浓硫酸微热制取氯化氢的化学方程式为
(2)新制氯水中含有的分子有:Cl2、H2O和
(3)已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
a.NaCl Na2SO4 b.NaCl NaBr Na2SO4
c.NaCl Na2SO4 I2 d.NaCl NaI Na2SO4.
考点:氯、溴、碘及其化合物的综合应用,氧化性、还原性强弱的比较,氯气的化学性质
专题:元素及其化合物
分析:(1)难挥发性的酸可以值得挥发性的酸;氯化氢是酸性气体,据此检验其生成;
(2)氯水的成分|水、氯气、次氯酸三种分子,氯离子、次氯酸根离子、氢离子、氢氧根离子四种离子,次氯酸见光易分解,在电解池的阳极上是失电子的氧化反应;
(3)氯气具有氧化性,能将还原性的离子按照还原性由强到弱的顺序依次氧化,碘单质易升华,溴单质易挥发,据此回答.
(2)氯水的成分|水、氯气、次氯酸三种分子,氯离子、次氯酸根离子、氢离子、氢氧根离子四种离子,次氯酸见光易分解,在电解池的阳极上是失电子的氧化反应;
(3)氯气具有氧化性,能将还原性的离子按照还原性由强到弱的顺序依次氧化,碘单质易升华,溴单质易挥发,据此回答.
解答:
解:(1)NaCl和浓硫酸微热制取氯化氢的化学方程式为NaCl+H2SO4(浓)
NaHSO4+HCl↑;氯化氢是酸性气体,能使湿的蓝色石蕊试纸变红(或湿的pH试纸变红,故答案为:NaCl+H2SO4(浓)
NaHSO4+HCl↑;湿的蓝色石蕊试纸(或湿的pH试纸);
(2)氯水的成分|水、氯气、次氯酸三种分子,氯离子、次氯酸根离子、氢离子、氢氧根离子四种离子,次氯酸见光易分解,2HClO
2HCl+O2↑在电解池的阳极上是失电子的氧化反应,电极饱和食盐水时,在阳极上是氯离子失电子的氧化反应,即 2Cl--2e→Cl2↑,故答案为:HClO; 2HClO
2HCl+O2↑; 2Cl--2e→Cl2↑;
(3)已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入一定量氯气后,先是和亚硫酸钠反应生成硫酸钠和氯化钠,再是和碘化钠反应生成氯化钠和碘单质,最后是和溴化钠反应生成氯化钠和溴单质,将溶液蒸干并充分灼烧,碘单质和溴单质均会变为蒸汽,如果加的氯气过量,则得到固体剩余物质的组成是氯化钠、硫酸钠,若较少氯气通入,此时溴化钠不能完全反应或是没反应,能获得硫酸钠、氯化钠、溴化钠固体,故答案为:ab.
| ||
| ||
(2)氯水的成分|水、氯气、次氯酸三种分子,氯离子、次氯酸根离子、氢离子、氢氧根离子四种离子,次氯酸见光易分解,2HClO
| ||
| ||
(3)已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入一定量氯气后,先是和亚硫酸钠反应生成硫酸钠和氯化钠,再是和碘化钠反应生成氯化钠和碘单质,最后是和溴化钠反应生成氯化钠和溴单质,将溶液蒸干并充分灼烧,碘单质和溴单质均会变为蒸汽,如果加的氯气过量,则得到固体剩余物质的组成是氯化钠、硫酸钠,若较少氯气通入,此时溴化钠不能完全反应或是没反应,能获得硫酸钠、氯化钠、溴化钠固体,故答案为:ab.
点评:本题以氯气的性质为载体考查学生元素和化合物的性质知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、SCN-、SO42- | ||
B、
| ||
| C、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | ||
| D、水电离产生的c(H+)=10-12mol?L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H═-197kJ/mol.下列说法正确的是( )
| A、使用催化剂可以提高SO2的转化率 |
| B、增大O2的浓度可以提高反应速率和SO2的转化率 |
| C、反应450℃时的平衡常数小于500℃时的平衡常数 |
| D、增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
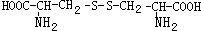
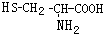 ,则下列说法错误的是
,则下列说法错误的是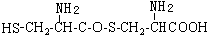
 可与NaOH溶液反应放出一种碱性气体.
可与NaOH溶液反应放出一种碱性气体.
 现有可逆反应:mA(g)+nB(g)?pC(g)+qD(g);根据如图示回答:
现有可逆反应:mA(g)+nB(g)?pC(g)+qD(g);根据如图示回答: