题目内容
7.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 标准状况下,每生成2.24L O2,转移的电子数一定为0.4NA | |
| B. | 常温下,7.8g苯中所含C-H数位0.6NA | |
| C. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| D. | 25℃时,1.0L PH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
分析 A标准状况下,每生成2.24L O2,物质的量=$\frac{2.24L}{22.4l/mol}$=0.1mol,可以是-1价氧元素生成也可以是-2价氧元素生成;
B.苯分子中的碳碳键为一种介于单键和双键之间的独特键,苯中单键为碳氢键;
C.1.8g甲基(-CD3)物质的量=$\frac{1.8g}{18g/mol}$=0.1mol,甲基不显电性,计算0.1mol-CD3含中子个数,质量数=质子数+中子数;
D.25℃时,1.0L PH=13的Ba(OH)2溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L,n=cV=$\frac{N}{{N}_{A}}$计算;
解答 解:A.标准状况下,每生成2.24L O2,物质的量=$\frac{2.24L}{22.4l/mol}$=0.1mol,可以是-1价氧元素生成,如过氧化钠和水反应,单质转移0.2NA,也可以是-2价氧元素生成如水分解,单质转移0.4NA,故A错误;
B.7.8g苯的物质的量为0.1mol,苯中不存在碳碳单键,0.1mol苯分子中含有0.6mol碳氢单键,则含有单键的数目为0.6NA,故B正确;
C.1.8g甲基(-CD3)物质的量=$\frac{1.8g}{18g/mol}$=0.1mol,甲基不显电性,故0.1mol-CD3含中子个数=0.1mol×[12-6+(2-1)×3]×NA=0.9NA,故C错误;
D.25℃时,1.0L PH=13的Ba(OH)2溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L,氢氧根离子数=0.1mol/L×1.0L×NA=0.1NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意苯分子中不存在碳碳单键,存在的单键为碳氢键.

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案| 实验目的 | 试剂 | 试管中的物质 |  | |
| A | 苯环对甲基的影响 | 酸性KMnO4溶液 | ①苯②甲苯 | |
| B | 比较Br-、Fe2+和I-的还原性 | 氯水 | ①FeBr2溶液②FeI2溶液 | |
| C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 | |
| D | 探究接触面积对反应速率的影响 | VmL、cmol/L的盐酸 | ①ag大理石块②ag大理石粉 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲酸(HCOOH)与正丁醇 | B. | 乙酸与甲醇(CH3OH) | ||
| C. | 乙醇与CH3CH2COOH | D. | CH3CH2COOH与甲醇(CH3OH) |
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液 | 将铁粉加入到一 定量氯化铁溶液中 |
 | 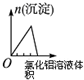 |  | 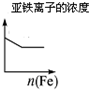 |
| A. | A | B. | B | C. | C | D. | D |
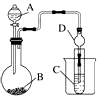 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.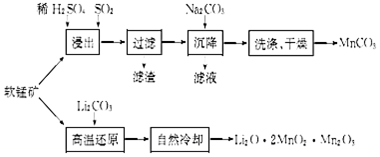
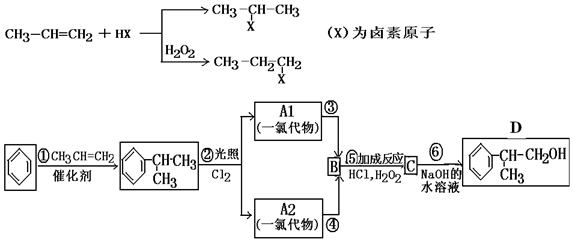
 ;
;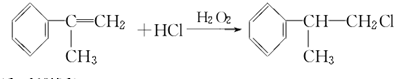 ;
;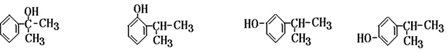 .
.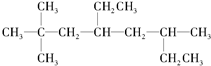 烃A的一氯代物具有不同沸点的产物有10种.
烃A的一氯代物具有不同沸点的产物有10种.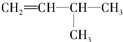 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.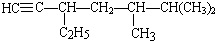 的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.
的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.