题目内容
1.有四种正盐的混合溶液,含有0.2mol•L-1Na+、0.25mol•L-1Mg2+、0.4mol•L-1Cl-,则SO42-的浓度为0.15mol/L.分析 任何电解质溶液中都遵循电荷守恒规律,根据电荷守恒计算硫酸根离子物质的量浓度.
解答 解:根据溶液呈电中性原则,溶液中应满足:2c(Mg2+)+c(Na+)=2c(SO42-)+c(Cl-),即0.25mol/L×2+0.2mol/L=0.4mol/L+2c(SO42-),解得c(SO42-)=0.15mol/L;
故答案为:0.15mol/L.
点评 本题考查混合溶液中离子浓度的计算,题目难度中等,注意掌握电荷守恒在化学计算中的应用方法,明确物质的量浓度的概念及表达式为解答关键.

练习册系列答案
相关题目
12.根据下列反应所画图象正确的是( )
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液 | 将铁粉加入到一 定量氯化铁溶液中 |
 | 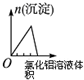 |  | 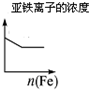 |
| A. | A | B. | B | C. | C | D. | D |
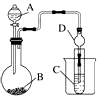 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.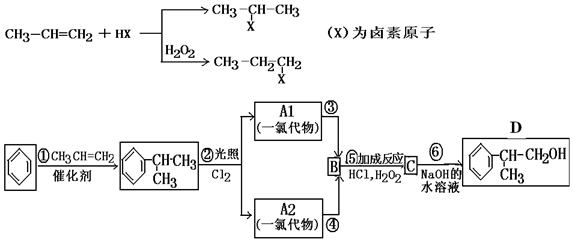
 ;
; ;
;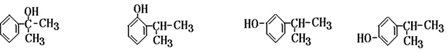 .
.
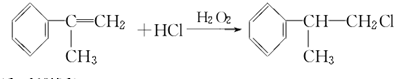
 烃A的一氯代物具有不同沸点的产物有10种.
烃A的一氯代物具有不同沸点的产物有10种.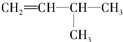 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
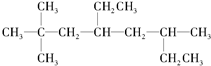
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.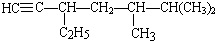 的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.
的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.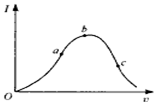 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: