题目内容
6. (1)某煤化工产业链的一部分发生某一反应,
(1)某煤化工产业链的一部分发生某一反应,已知该产业链中反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,则它所对应反应的化学方程式是C+H2O?CO+H2.
(2)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1
已知:C(s)+O2(g)=CO2 (g)△H1=a kJ•mol-1
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为(3a+b-c).
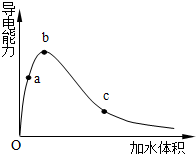
(3)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,请回答下列问题:
①写出冰醋酸电离方程式CH3COOH?CH3COO-+H+
②加水过程中,其水溶液导电能力变化的原因是:开始加入水,醋酸发生电离,溶液中离子浓度增大,溶液导电能力增强,一定程度后再加入水,溶液体积为影响离子浓度主要元素,溶液中离子浓度又减小,溶液导电能力降低
③a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:相等(填“相同”、“a点大”、“b点大”、“c点大”)
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)已知:①C(s)+O2(g)=CO2 (g)△H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
根据盖斯定律,①×3+②-③可得:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=3△H1+△H2-△H3;
(3)①醋酸是弱电解质,电离得到醋酸根离子与氢离子;
②溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
③a、b、c三点溶液中溶质HAc的物质的量相等,则消耗NaOH相等.
解答 解:(1)反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,由元素守恒可知,反应物还有固体C,结合平衡常数表达式,可知反应的化学方程式是:C+H2O?CO+H2,
故答案为:C+H2O?CO+H2;
(2)已知:①C(s)+O2(g)=CO2 (g)△H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
根据盖斯定律,①×3+②-③可得:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=3△H1+△H2-△H3,故x=(3a+b-c),
故答案为:(3a+b-c);
(3)①酸是弱电解质,电离得到醋酸根离子与氢离子,电离方程式为:CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
②溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,开始加入水,醋酸发生电离,溶液中离子浓度增大,溶液导电能力增强,一定程度后再加入水,溶液体积为影响离子浓度主导因素,溶液中离子浓度又减小,溶液导电能力降低,
故答案为:开始加入水,醋酸发生电离,溶液中离子浓度增大,溶液导电能力增强,一定程度后再加入水,溶液体积为影响离子浓度主导因素,溶液中离子浓度又减小,溶液导电能力降低;
所以冰醋酸不导电
③a、b、c三点溶液中溶质HAc的物质的量相等,则消耗NaOH的物质的量相等,则消耗氢氧化钠溶液体积相等,
故答案为:相等.
点评 本题考查弱电解质的电离、运用盖斯定律计算反应热、化学平衡常数等,理解溶液导电能力的影响因素,注意加水稀释醋酸,能促进醋酸电离,但开始离子物质的量为影响离子浓度主导因素,后半段溶液体积为影响离子浓度主导因素.

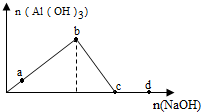
| A. | a点对应的溶液中:K+、NH4+、I-、CO32- | |
| B. | b点对应的溶液中:Na+、H+、S2-、Cl- | |
| C. | c点对应的溶液中:NH4+、H+、NO3-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO42-、HCO3- |
| A. | 二氯甲烷分子为正四面体结构 | |
| B. | 2-丁烯分子中4个碳原子不在同一平面内 | |
| C. | 甲苯分子中7个碳原子都在同一平面内 | |
| D. | 丙烷分子中的3个碳原子一定在同一条直线上 |
| A. | Fe2+具有氧化性,维生素C具有还原性 | |
| B. | Fe2+具有氧化性,维生素C也具有氧化性 | |
| C. | Fe2+具有还原性,维生素C具有氧化性 | |
| D. | Fe2+具有还原性,维生素C也具有还原性 |
| A. | 金属铜在物质分类中属于单质,所以它既不是电解质也不是非电解质 | |
| B. | 强电解质水溶液的导电性一定比弱电解质水溶液的导电性强 | |
| C. | 用硫化亚铁除去污水中的铜离子,是利用硫化亚铁比硫化铜在水中更难溶 | |
| D. | 对于已经达到平衡的化学反应,改变压强,平衡常数(K)可能改变 |
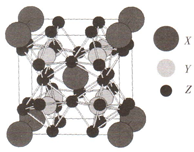 某种能实现热电效应的晶体的晶胞模型如右图.已知晶胞的六个面的原子数相同,Y原子位于Z原子围成的八面体中心.下列说法正确的是( )
某种能实现热电效应的晶体的晶胞模型如右图.已知晶胞的六个面的原子数相同,Y原子位于Z原子围成的八面体中心.下列说法正确的是( )| A. | 距离X最近的Y原子有8个 | B. | 距离X最近的X原子有6个 | ||
| C. | 距离X最近的Z原子有3个 | D. | 该晶体的化学式为X2Y8Z12 |
| A. | 金属钠 | B. | 浓硝酸 | C. | FeSO4溶液 | D. | 浓硫酸 |
| A. | pH=0的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(H+)=1×10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- | |
| C. | 含有大量Fe3+的溶液中:Na+、I-、K+、NO3- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、[Al(OH)4]-、S2-、CO32- |
| A. | 稀硫酸与氧氧化钡溶液反应 | B. | 稀硫酸与氯化钡溶液反应 | ||
| C. | 稀硫酸与碳酸钡反应 | D. | 硫酸氢钠溶液与氢氧化坝溶液反应 |