题目内容
(1)某同学利用CuSO4溶液,进行以下实验探究.

①图一是根据反应Zn+CuSO4═Cu+ZnSO4 设计成的锌铜原电池.Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”).
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L.
(2)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是 .
A.c(K+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(K+)>c(CO32-)>c(H+)>c(OH-) D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-)
E.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)

①图一是根据反应Zn+CuSO4═Cu+ZnSO4 设计成的锌铜原电池.Cu极的电极反应式是
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是
(2)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是
A.c(K+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(K+)>c(CO32-)>c(H+)>c(OH-) D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-)
E.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①负极为Zn,Cu为正极,正极上铜离子得到电子发生还原反应,溶液中阳离子向正极移动;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,正极上氧气得电子,a为负极,负极上甲烷失电子;根据转移的电子守恒计算;
(2)A、根据电荷守恒判断;
B、根据质子恒等式判断;
C、根据K2CO3溶液呈碱性判断;
D、溶液中OH-来源于水的电离,HCO3-、CO32-水解,则c(OH-)>c(HCO3-);
E、根据物料守恒判断.
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,正极上氧气得电子,a为负极,负极上甲烷失电子;根据转移的电子守恒计算;
(2)A、根据电荷守恒判断;
B、根据质子恒等式判断;
C、根据K2CO3溶液呈碱性判断;
D、溶液中OH-来源于水的电离,HCO3-、CO32-水解,则c(OH-)>c(HCO3-);
E、根据物料守恒判断.
解答:
解:(1)①负极为Zn,Cu为正极,正极上铜离子得到电子发生还原反应,电极反应为Cu2++2e-=Cu,溶液中阳离子向正极移动,即K+向乙中移动,
故答案为:Cu2++2e-=Cu;乙;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,即b处通入O2,a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O,当铜电极的质量减轻3.2g,则n(Cu)=
=0.05mol,已知Cu电极的反应为Cu-2e-=Cu2+,所以转移电子为0.1mol,燃料电池中CH4-8e-+10OH-=CO32-+7H2O,则n(CH4)=
n(e-)=0.125mol,所以消耗的CH4在标准状况下的体积为0.125mol×22.4L/mol=0.28L;
故答案为:O2;CH4-8e-+10OH-=CO32-+7H2O;0.28;
(2)A、电荷不守恒,其电荷守恒为:c(K+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B、溶液中OH-来源于水的电离及CO32-、HCO3-与水的水解反应,每产生1个H2CO3,分子,生成2个OH-,故c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故B正确;
C、K2CO3溶液呈碱性判断,故c(H+)<c(OH-),故C错误;
D、溶液中OH-来源于水的电离,HCO3-、CO32-水解,所以c(OH-)>c(HCO3-),盐类水解很微弱,所以c(CO32-)>c(OH-),故c(K+)>c(CO32-)>c(OH-)>c(HCO3-),故D正确;
E、根据物料守恒c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故E错误;
故选:BD.
故答案为:Cu2++2e-=Cu;乙;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,即b处通入O2,a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O,当铜电极的质量减轻3.2g,则n(Cu)=
| 3.2g |
| 64g/mol |
| 1 |
| 8 |
故答案为:O2;CH4-8e-+10OH-=CO32-+7H2O;0.28;
(2)A、电荷不守恒,其电荷守恒为:c(K+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B、溶液中OH-来源于水的电离及CO32-、HCO3-与水的水解反应,每产生1个H2CO3,分子,生成2个OH-,故c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故B正确;
C、K2CO3溶液呈碱性判断,故c(H+)<c(OH-),故C错误;
D、溶液中OH-来源于水的电离,HCO3-、CO32-水解,所以c(OH-)>c(HCO3-),盐类水解很微弱,所以c(CO32-)>c(OH-),故c(K+)>c(CO32-)>c(OH-)>c(HCO3-),故D正确;
E、根据物料守恒c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故E错误;
故选:BD.
点评:本题考查盐类水解、原电池、电镀、离子浓度大小比较,是对所学知识的综合考查,难度较大,离子浓度大小比较、电极反应式书写为易错点.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、向Mg(OH)2悬浊液中加入FeCl3溶液:3OH-+Fe3+═Fe(OH)3↓ |
| B、淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=4OH-+2I2 |
| C、用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+13H+=4Cr3++11H2O+3CH3COO- |
| D、次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- |
下列离子方程式正确的是( )
| A、Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| B、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
| C、100mL 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓ |
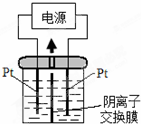 电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )| A、右侧发生的电极方程式:O2+4e-+2H2O=4OH- |
| B、电解槽内发生反应的总化学方程式是KI+3H2O=KIO3+3H2↑ |
| C、电解结束后,右侧溶液中不可能含有IO3- |
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变 |




 断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E: (1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:
(1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极: S2Cl2常用于橡胶硫化,有机物氯化的试剂,某研究性学习小组拟用实验室常用试剂和仪器合成S2Cl2.
S2Cl2常用于橡胶硫化,有机物氯化的试剂,某研究性学习小组拟用实验室常用试剂和仪器合成S2Cl2.