题目内容
 S2Cl2常用于橡胶硫化,有机物氯化的试剂,某研究性学习小组拟用实验室常用试剂和仪器合成S2Cl2.
S2Cl2常用于橡胶硫化,有机物氯化的试剂,某研究性学习小组拟用实验室常用试剂和仪器合成S2Cl2.查阅资料获息:
①S2Cl2可由氯气通入熔融硫中制得.Cl2+2S(熔融)=S2Cl2
②S2Cl2主要性质:
纯净S2Cl2为无色油状液体,常含杂质呈红黄色,熔点-80℃,沸点138℃,有窒息性恶臭,在空气中强烈发烟,能刺激眼睛引起流泪,遇水强烈分解生成S、SO2和HCl;
③硫:
斜方硫:熔点112.8℃,沸点446.6℃,着火点363℃
单斜硫:熔点119.2℃,沸点446.6℃,着火点363℃
④设计仪器装置,部分药品如图.(必要时仪器装置可重复使用)
请回答下列问题:
(1)已知S2Cl2分子中各原子均达8电子稳定结构,请用电子式表示其形成过程:
其结构中化学键类型有:
(2)制取Cl2应选用的装置是:
反应的离子方程式为:
(3)斜方硫,单斜硫互称为:
(4)欲得到较纯净的S2Cl2,上述仪器装置连接顺序是:(按气流从左到右流向填接口代号)
(5)你认为仪器装置选用中是否有不足之处,若没有此空可不必作答;若有,请选用与题目不重复的仪器和药品以达到目的,将图画在F处,并简要说明理由
考点:制备实验方案的设计
专题:实验设计题
分析:(1)依据S2Cl2分子中各原子均达8电子稳定结构,说明硫原子和硫原子间形成一对公用电子对,和一个氯原子形成一个公用电子对,依据形成共价键的过程分析写出;分析化学键的形成和特征是极性键S-Cl和非极性键S-S;
(2)分析装置图可知制备氯气是利用二氧化锰和浓盐酸加热反应生成的原理分析选择装置图为B,依据原理和反应写出离子方程式;
(3)同种元素组成的不同单质属于同素异形体;分析数据调整得到结论固体结构不同,液体结构相同;
(4)依据题干信息分析,S2Cl2可由氯气通入熔融硫中制得.Cl2+2S(熔融)=S2Cl2 ;依据原理选择装置;制备出的氯气中含有氯化氢和水蒸气,需要用饱和食盐水和浓硫酸分别除去,得到干燥纯净的氯气,通入装置C中加热与硫反应生成S2Cl2,依据S2Cl2分子的性质分析,熔点-80℃,沸点138℃,有窒息性恶臭,在空气中强烈发烟,能刺激眼睛引起流泪,遇水强烈分解生成S、SO2和HCl,在装置A中冷却得到液态S2Cl2,为防止空气中水蒸气进入和液态S2Cl2反应最后需要连接装置E;
(5)实验过程中多余的有毒气体不能排放到空气中,需要进行尾气吸收装置;
(2)分析装置图可知制备氯气是利用二氧化锰和浓盐酸加热反应生成的原理分析选择装置图为B,依据原理和反应写出离子方程式;
(3)同种元素组成的不同单质属于同素异形体;分析数据调整得到结论固体结构不同,液体结构相同;
(4)依据题干信息分析,S2Cl2可由氯气通入熔融硫中制得.Cl2+2S(熔融)=S2Cl2 ;依据原理选择装置;制备出的氯气中含有氯化氢和水蒸气,需要用饱和食盐水和浓硫酸分别除去,得到干燥纯净的氯气,通入装置C中加热与硫反应生成S2Cl2,依据S2Cl2分子的性质分析,熔点-80℃,沸点138℃,有窒息性恶臭,在空气中强烈发烟,能刺激眼睛引起流泪,遇水强烈分解生成S、SO2和HCl,在装置A中冷却得到液态S2Cl2,为防止空气中水蒸气进入和液态S2Cl2反应最后需要连接装置E;
(5)实验过程中多余的有毒气体不能排放到空气中,需要进行尾气吸收装置;
解答:
解:(1)S2Cl2分子中各原子均达8电子稳定结构,是共价化合物,硫原子和硫原子间形成一对公用电子对,和一个氯原子形成一个公用电子对,电子式表示的形成过程为: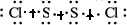 →
→ ,形成过程中硫原子间,硫原子核氯原子间形成的是共价键,其中S-S是非极性共价键,S-Cl是极性共价键;
,形成过程中硫原子间,硫原子核氯原子间形成的是共价键,其中S-S是非极性共价键,S-Cl是极性共价键;
故答案为: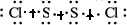 →
→ 极性键,非极性键;
极性键,非极性键;
(2)装置图可知制备氯气是利用二氧化锰和浓盐酸加热反应生成的原理分析选择装置图为B,依据原理和反应写出离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
故答案为:B,MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(3)斜方硫,单斜硫是硫元素组成的不同单质互称为同素异形体,斜方硫:熔点112.8℃,沸点446.6℃,着火点363℃,单斜硫:熔点119.2℃,沸点446.6℃,着火点363℃,对比数据可知,固态的结构不同,液态时结构相同;
故答案为:同素异形体,固态的结构不同,液态时结构相同;
(4)依据题干信息分析,S2Cl2可由氯气通入熔融硫中制得.Cl2+2S(熔融)=S2Cl2 ;依据原理选择装置;制备出的氯气中含有氯化氢和水蒸气,需要用饱和食盐水和浓硫酸分别除去,得到干燥纯净的氯气,通入装置C中加热与硫反应生成S2Cl2,依据S2Cl2分子的性质分析,熔点-80℃,沸点138℃,有窒息性恶臭,在空气中强烈发烟,能刺激眼睛引起流泪,遇水强烈分解生成S、SO2和HCl,在装置A中冷却得到液态S2Cl2,为防止空气中水蒸气进入和液态S2Cl2反应最后需要连接装置E,装置连接顺序为:c→f,g→h,i→d,e→a,b→h;
故答案为:c→f,g→h,i→d,e→a,b→h;
(5)设计中缺吸收尾气的装置与药品,在导管b后添加一个装有碱石灰干燥管,用于防止氯气等有毒气体污染空气,装置图为: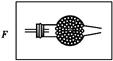 ;
;
故答案为:设计中缺吸收尾气的装置与药品,在导管b后添加一个装有碱石灰干燥管, ;
;
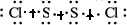 →
→ ,形成过程中硫原子间,硫原子核氯原子间形成的是共价键,其中S-S是非极性共价键,S-Cl是极性共价键;
,形成过程中硫原子间,硫原子核氯原子间形成的是共价键,其中S-S是非极性共价键,S-Cl是极性共价键;故答案为:
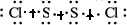 →
→ 极性键,非极性键;
极性键,非极性键;(2)装置图可知制备氯气是利用二氧化锰和浓盐酸加热反应生成的原理分析选择装置图为B,依据原理和反应写出离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:B,MnO2+4H++2Cl-
| ||
(3)斜方硫,单斜硫是硫元素组成的不同单质互称为同素异形体,斜方硫:熔点112.8℃,沸点446.6℃,着火点363℃,单斜硫:熔点119.2℃,沸点446.6℃,着火点363℃,对比数据可知,固态的结构不同,液态时结构相同;
故答案为:同素异形体,固态的结构不同,液态时结构相同;
(4)依据题干信息分析,S2Cl2可由氯气通入熔融硫中制得.Cl2+2S(熔融)=S2Cl2 ;依据原理选择装置;制备出的氯气中含有氯化氢和水蒸气,需要用饱和食盐水和浓硫酸分别除去,得到干燥纯净的氯气,通入装置C中加热与硫反应生成S2Cl2,依据S2Cl2分子的性质分析,熔点-80℃,沸点138℃,有窒息性恶臭,在空气中强烈发烟,能刺激眼睛引起流泪,遇水强烈分解生成S、SO2和HCl,在装置A中冷却得到液态S2Cl2,为防止空气中水蒸气进入和液态S2Cl2反应最后需要连接装置E,装置连接顺序为:c→f,g→h,i→d,e→a,b→h;
故答案为:c→f,g→h,i→d,e→a,b→h;
(5)设计中缺吸收尾气的装置与药品,在导管b后添加一个装有碱石灰干燥管,用于防止氯气等有毒气体污染空气,装置图为:
 ;
;故答案为:设计中缺吸收尾气的装置与药品,在导管b后添加一个装有碱石灰干燥管,
 ;
;
点评:本题考查了物质制备的实验分析判断,依据原理的装置选择和连接,掌握物质性质和实验基本操作是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
| B、向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| C、用过量氨水吸收工业尾气中的SO2:2NH3?H20+SO2═2NH4++SO32-+H2O |
| D、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
下列叙述正确的是( )
| A、0.01mol/L CH3COOH与pH=12的NaOH溶液混合,若混合后c(CH3COO-)>c(Na+),则混合液一定呈碱性 |
| B、常温下,将等体积0.01mol/L HCl与pH=12的氨水混合,则混合液的pH=7 |
| C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA-)+2c(A2-) |
| D、将5mL 0.02mol/L的H2SO4与5mL 0.02mol/L NaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=7 |
部分弱酸的电离平衡常数如下表,下列选项错误的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) |
Ka=1.8×10-5 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、CN-+H2O+CO2=HCN+HCO3- |
| B、2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ |
| C、中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者 |
| D、等体积、等浓度的CH3COONa和NaCN溶液中所含离子总数前者小于后者 |
下列离子方程式书写不正确的是( )
| A、等物质的量的 CO2与氢氧化钠溶液反应:CO2+OH-=HCO3- | ||||
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | ||||
| C、Ca(OH)2溶液与等物质的量的稀H2SO4混合:Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O | ||||
D、用石墨电极电解饱和食盐水:2H2O+2Cl-
|


