��Ŀ����
 ij���Ӿ��徧���ṹ��ͼ������Xλ��������Ķ��㣬����Yλ������������ģ��Է�����
ij���Ӿ��徧���ṹ��ͼ������Xλ��������Ķ��㣬����Yλ������������ģ��Է�������1��������ÿ��Yͬʱ������
��2�������о��������2��X��һ��Y�γɵļнǡ�XYX=
��3��������������ⳤΪa cm�������ܶ�Ϊ��g?cm-3��NAΪ�����ӵ�������ֵ��������ӻ������Ħ������Ϊ
���㣺�����ļ���
ר�⣺��ѧ���뾧��ṹ
��������1������ͼƬ֪��ÿ��Yͬʱ������4��X��ÿ��Xͬʱ������8��Y�����þ�̯��ȷ���仯ѧʽ��
��2���ĸ�X������������ṹ��Yλ�������������ģ����ֽṹ�����Ľṹ��ȫ��ͬ���ݴ��жϡ�XYX�Ķ�����
��3�����ݦ�=
����M��
��2���ĸ�X������������ṹ��Yλ�������������ģ����ֽṹ�����Ľṹ��ȫ��ͬ���ݴ��жϡ�XYX�Ķ�����
��3�����ݦ�=
| ||||
| V |
���
��1������ͼƬ֪��ÿ��Yͬʱ������4��X��ÿ��Xͬʱ������8��Y���þ�����Y���Ӹ�����1��X���Ӹ���=4��
=
����X��Y���ӵĸ�����Ϊ
��1=1��2�������仯ѧʽΪXY2��Y2X��
�ʴ�Ϊ��4��8��XY2����Y2X����
��2���ĸ�X������������ṹ��Yλ�������������ģ����ֽṹ�����Ľṹ��ȫ��ͬ�������о��������2��X��1��Y�γɵļнǡ�XYX�Ķ���Ϊ109��28�䣬
�ʴ�Ϊ��109��28�䣻
��3�����ݦ�=
֪��M=2��VNA=2a3��NA g/mol��
�ʴ�Ϊ��2a3��NA g/mol��
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
�ʴ�Ϊ��4��8��XY2����Y2X����
��2���ĸ�X������������ṹ��Yλ�������������ģ����ֽṹ�����Ľṹ��ȫ��ͬ�������о��������2��X��1��Y�γɵļнǡ�XYX�Ķ���Ϊ109��28�䣬
�ʴ�Ϊ��109��28�䣻
��3�����ݦ�=
| ||||
| V |
�ʴ�Ϊ��2a3��NA g/mol��
���������⿼�龧���ļ��㡢��ѧʽ��ȷ������λ�����жϵ�֪ʶ�㣬�ѵ���Ħ�������ļ��㣬���ݻ�����ʽ�����Ƶ�������Ѷ��еȣ�

��ϰ��ϵ�д�
 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
�����Ŀ
������ȷ��ʾ���л�ѧ��Ӧ�����ӷ���ʽ�ǣ�������
| A������������Һ������ķ�Ӧ OH-+H+=H2O |
| B��ͭƬ������������Һ�� Cu+2Ag+=Cu2++2Ag |
| C�������ʯ��ˮ��ϡ���ᷴӦ Ca��OH��2+2H+=Ca2++2H2O |
| D��̼��������ϡ������ CO32-+2H+=H2O+CO2�� |
��ͬ�¶ȡ���ͬŨ���µ����ֵ������Һ����pH��С�����˳����ͼ��ʾ��ͼ�Т٢ڢ۴��������ʿ��ֱܷ�Ϊ��������


| A��CH3COOH��HCl��CH3COONa |
| B��HCl��CH3COOH��CH3COONa |
| C��NH4Cl��CH3COOH��NaOH |
| D��NH4Cl��HCl��NaHCO3 |
KCl��KBr�Ļ����3.87g����ˮ�У����������AgNO3��Һ����ַ�Ӧ�õ�����6.63g����ԭ������м�Ԫ�ص���������Ϊ��������
| A��0.241 |
| B��0.259 |
| C��0.403 |
| D��0.487 |
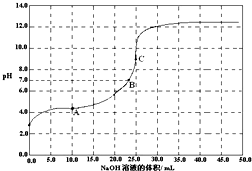 ����ʱ����0.1000mol/L NaOH �ζ� 25.00mL 0.1000mol/LijһԪ��HX���ζ�������pH �仯������ͼ��ʾ������˵����ȷ���ǣ�������
����ʱ����0.1000mol/L NaOH �ζ� 25.00mL 0.1000mol/LijһԪ��HX���ζ�������pH �仯������ͼ��ʾ������˵����ȷ���ǣ�������| A���ζ�ǰ������c��H+�� ���ڼ���c��OH-�� |
| B����A�㣬c��Na+����c��X-����c��HX����c��H+����c��OH-�� |
| C����B�㣬����ǡ����ȫ��Ӧ |
| D����C�㣬c��X-��+c��HX��=0.05 mol/L |

 �������������ʡ�����ȵ���Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ�е��о�
�������������ʡ�����ȵ���Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ�е��о�