题目内容
14.下列有关化学用语表示正确的是( )| A. | CSO的电子式: | |
| B. | 甲烷分子的球棍模型: | |
| C. | 2-戊烯的结构简式CH3CH2CHCHCH3 | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
分析 A.类比二氧化碳的电子式进行判断;
B. 为甲烷的比例模型,不是球棍模型;
为甲烷的比例模型,不是球棍模型;
C.碳碳双键为官能团,不能省略;
D.碳酸氢根水解生成碳酸和氢氧根离子.
解答 解:A.CSO中碳原子分别与氧原子和硫原子生成了两对共用电子对,其电子式: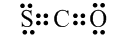 ,故A正确;
,故A正确;
B.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为: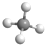 ,故B错误;
,故B错误;
C.2-戊烯的结构简式CH3CH2CH=CHCH3,故C错误;
D.HCO3-的水解方程式为:HCO3-+H2O?H2CO3+OH-,故D错误;
故选:A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及比例模型与球棍模型、结构简式、水解方程式的书写,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
4.将金属钠放在燃烧匙中加热使其燃烧,观察到的现象是( )
| A. | 金属钠熔化成小球 | B. | 燃烧后得到白色固体 | ||
| C. | 火焰为黄色 | D. | 燃烧后得到淡黄色固体 |
2.下列反应中,属于加成反应的是( )
| A. | 苯与液溴在FeBr3催化下生成溴苯 | |
| B. | 乙醇在铜做催化剂的条件下,被空气中的氧气氧化成乙醛 | |
| C. | 乙烯使溴水褪色 | |
| D. | 乙酸与乙醇反应生成乙酸乙酯 |
6.下列有关实验原理或操作正确的是( )

| A. | ①液体分层,下层呈无色 | |
| B. | ②洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. | ③分离CCl4和水 | |
| D. | ④除去氯气中的氯化氢 |
3.常温下,向10mL 0.1mol•L-1的H2C2O4溶液中逐滴加入0.1mol•L-1KOH溶液,所得滴定曲线如图所示.下列说法正确的是( )

| A. | KHC2O4溶液呈弱碱性 | |
| B. | B点时:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | C点时:c(K+)<c(HC2O4- )+2c(C2O42-)+c(H2C2O4) | |
| D. | D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
15.能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一.
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)?CO(g)+3H2(g)△H1>0
II.CO(g)+2H2(g)?CH3OH(g)△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图所示.

①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1;
②图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1;.
③若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min时只改变了某一条件,10min时测得各物质浓度如表,则所改变的条件是向容器中充入1molH2;10min时v正>v逆(填“<”、“>”或“=”).
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)?CO(g)+3H2(g)△H1>0
II.CO(g)+2H2(g)?CH3OH(g)△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图所示.

①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1;
②图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1;.
③若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
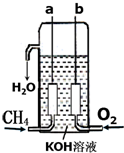 氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.