题目内容
8.NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )| A. | 标准状况下,1 L庚烷所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| B. | 1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
分析 A、标况下庚烷为液态;
B、甲基不显电性;
C、求出混合物的物质的量,然后根据B2H6和C2H4均含16个电子来分析;
D、C2H2和苯的最简式均为CH.
解答 解:A、标况下庚烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、甲基不显电性,故1mol甲基含9mol电子即9NA个,故B正确;
C、标况下22.4L混合气体的物质的量为1mol,而B2H6和C2H4均含16个电子,故1mol混合气体中含16NA个电子,故C正确;
D、C2H2和苯的最简式均为CH,故26g混合物中含有的CH的物质的量为2mol,则含2NA个C原子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
18.已知:可逆反应N2(g)+3H2(g)?2NH3(g)△H<0.现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ.在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2.下列叙述中正确的是( )
| A. | Q1+Q2=92.4 | |
| B. | 达平衡时甲、乙中NH3的体积分数乙>甲 | |
| C. | 达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动 | |
| D. | 达平衡时甲中N2的转化率为25% |
19.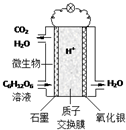 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| C. | 石墨电极上反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况) |
16.下列措施肯定能使化学反应速率加快的是( )
| A. | 增加反应物的量 | B. | 增加压强 | C. | 升高温度 | D. | 缩小容器的体积 |
3.反应A+3B=2C+D在四种不同情况下的反应速率的快慢顺序为( )
①V(A)=0.15mol/(L•s)
②V(B)=36mol/(L•min)
③V(C)=0.5mol/(L•s)
④V(D)=0.45mol/(L•s)
①V(A)=0.15mol/(L•s)
②V(B)=36mol/(L•min)
③V(C)=0.5mol/(L•s)
④V(D)=0.45mol/(L•s)
| A. | ④>③>①>② | B. | ④>③>②>① | C. | ②>③>④>① | D. | ②>④>③>① |
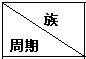
20.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)表中能形成两性氢氧化物的元素是铝(写元素名称),该元素在元素周期表中的位置是第三周期第ⅢA族,写出该元素对应氧化物与氢氧化钠反应的化学方程式NaOH+Al(OH)3═NaAlO2+2H2O.
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.(写化学式)
⑧⑨⑩对应的气态氢化物的稳定性从大到小的顺序是HF>HCl>HBr.(用化学式表示)
(3)元素⑦的氢化物电子式为 ,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)
,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)
(4)判断元素④和⑧对应的常见单质氧化性的强弱Cl2>S(用化学式表示),并用化学方程式阐明你的判断:Na2S+Cl2=2NaCl+S.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑩ | |||||
| 三 | ① | ③ | ⑤ | ④ | ⑧ | ⑪ | ||
| 四 | ② | ⑨ |
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.(写化学式)
⑧⑨⑩对应的气态氢化物的稳定性从大到小的顺序是HF>HCl>HBr.(用化学式表示)
(3)元素⑦的氢化物电子式为
 ,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)
,该氢化物与其最高价含氧酸反应生成的化合物中含有的化学键类型是离子键、共价键,属于离子化合物(填“离子”或“共价”)(4)判断元素④和⑧对应的常见单质氧化性的强弱Cl2>S(用化学式表示),并用化学方程式阐明你的判断:Na2S+Cl2=2NaCl+S.
17.下列化学键类型相同晶体类型也相同的是( )
| A. | 晶体SiO2与干冰 | B. | NaCl与HCl | C. | 金刚石和C60 | D. | NH4Cl与NaOH |
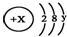 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题: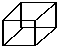 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线: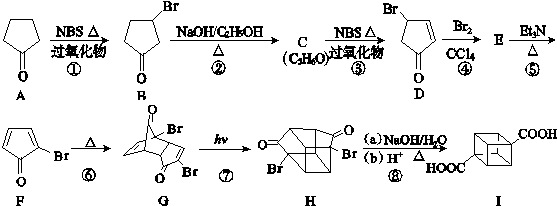
 ,E的结构简式为
,E的结构简式为 .
.
 ;
;