题目内容
2.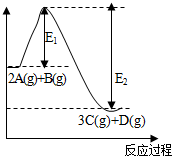 反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:
反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:(1)a<0 (填“<”“>”“=”),升高温度该反应化学平衡常数减小(填“增大”或“减小”).
(2)该反应的熵变△s>0(填“<”“>”“=”),在任何(填“高”、“低”、“任何”)温度能正向自发进行.
(3)若反应在恒容恒温条件下进行,且A、B的起始浓度分别为5mol/L、2mol/L,10min后平衡时D的浓度为1mol/L,C物质的量为3mol,则容器的容积为1L,B的转化率为50%,A的反应速率为0.2mol/(L•min),化学平衡常数为3.
分析 (1)根据反应物和生成物的总能量判断反应是放热还是吸热反应;温度升高平衡向吸热方向移动,平衡正向移动时,平衡常数增大;
(2)根据气体反应物和气体生成物的化学计量数和的大小判断△s,结合△G=△H-T△s<0判断;
(3)根据平衡三行式计算出平衡状态,即可根据相关公式计算出容积的体积、B的转化率、A的反应速率及化学平衡常数.
解答 解:(1)由能量变化图可知,反应物的总能量大于生成物,此反应为放热反应,即△H<0,则a<0;此可逆反应升高温度时,平衡逆向移动,平衡常数减小,故答案为:<;减小;
(2)已知反应2A(g)+B(g)?3C(g)+D(g),正方向是气体总量增大的方向,即△s>0;已知此反应的
△H<0、△s>0,根据△G=△H-T△s可知,在任何温度下,△G均小于0,即均能自发进行,故答案为:>;任何;
(3)2A(g)+B(g)?3C(g)+D(g)
起始浓度(mol/L) 5 2 0 0
变化浓度(mol/L) 2 1 3 1
平衡浓度(mol/L) 3 1 3 1
则:容器的体积V=$\frac{3mol}{3mol/L}$=1L;
B的转化率为:$\frac{1mol/L}{2mol/L}$×100%=50%;
A的平衡反应速率为:$\frac{2mol/L}{10min}$=0.2mol/(L•min;
此反应的平衡常数K=$\frac{{c}^{3}(C)×c(D)}{{c}^{2}(A)×c(B)}$=$\frac{{3}^{3}×1}{{3}^{2}×1}$=3,
故答案为:1;50%;0.2mol/(L•min);3.
点评 考查化学反应中的能量变化与焾变、熵变的关系及化学平衡的有关计算,涉及平衡常数的影响因素和反应自发进行的复合判断的综合应用,基础考查,难度中等.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 硅太阳能电池工作时,光能转化成电能 | |
| B. | 锂离子电池放电时,化学能转化成电能 | |
| C. | 电解质溶液导电时,电能转化成化学能 | |
| D. | 葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
| A. | 氯仿 | B. | 一氯甲烷 | C. | 一氯乙烷 | D. | 乙醇 |

| A. | 制取SO2 | B. | 验证漂白性 | C. | 收集SO2 | D. | 尾气处理 |
| A. | 金刚石的燃烧热比石墨的燃烧热小 | B. | 石墨一定不如金刚石稳定 | ||
| C. | 石墨的能量比金刚石的能量高 | D. | 由石墨制备金刚石一定是吸热反应 |
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})•c({H}^{+})}$增大 | |
| B. | 通入CO2,或者加入少量氯化铵溶液,溶液pH均减小 | |
| C. | 升高温度,红色变深,平衡常数增大 | |
| D. | 加入NaOH固体,$\frac{c(HCO_3^-)}{{c(CO_3^{2-})}}$减小 |
| A. | NO是具有刺激性的红棕色气体 | |
| B. | SO3溶于水生成亚硫酸 | |
| C. | 向品红溶液中通入二氧化硫气体,溶液褪色,加热后溶液又会出现红色 | |
| D. | 氨水中滴入酚酞溶液,颜色变蓝 |