题目内容
14.已知金刚石在一定条件下转化为石墨是放热的.据此,以下判断或说法正确的是( )| A. | 金刚石的燃烧热比石墨的燃烧热小 | B. | 石墨一定不如金刚石稳定 | ||
| C. | 石墨的能量比金刚石的能量高 | D. | 由石墨制备金刚石一定是吸热反应 |
分析 A.燃烧热为1mol物质完全燃烧并且生成的物质为最稳当的氧化物放出的热量;
B.物质具有的能量越高,该物质越不稳定;
C.金刚石在一定条件下转化为石墨是放热,金刚石能量高;
D.金刚石在一定条件下转化为石墨是放热,反之一定是吸热反应.
解答 解:A.放热反应为反应物的总能量大于生成物的总能量,金刚石在一定条件下转化为石墨是放热,说明金刚石具有的能量高,燃烧热为1mol物质完全燃烧,则金刚石的燃烧热比石墨的燃烧热大,故A错误;
B.金刚石在一定条件下转化为石墨是放热,则石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨比金刚石稳定,故B错误;
C.石墨转化为金刚石要吸收能量,说明石墨的能量低于金刚石,故C错误;
D.金刚石在一定条件下转化为石墨是放热,由石墨制备金刚石一定是吸热反应,故D正确;
故选D.
点评 本题考查金刚石和石墨的转化以及涉及到的能量变化,注意能量低的物质更稳定即可解答,题目难度不大,但容易解答错误,侧重分析能力的考查.

练习册系列答案
相关题目
20.下列实验操作所得的现象及结论均正确的是( )
| 选项 | 实验操作 | 现象及结论 |
| A | 将AlC13溶液加热蒸干 | 得到白色固体,成分为纯净的AlC13 |
| B | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生,则Na2SO3己变质 |
| C | 用量筒量取一定体积的浓硫酸时,仰视读数 | 所量取的浓硫酸体积偏大 |
| D | 向FeI2溶液中通入少量C12 | 溶液变黄,则C12的氧化性强于Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
9.燃烧0.2mol某有机物,得到0.4mol CO2和 0.6mol H2O,由此可得出的结论是( )
| A. | 该有机物中含有2个碳原子和6个氢原子 | |
| B. | 该有机物中碳和氢的原子个数比为3:1 | |
| C. | 该有机物中含有2个CO2和3个H2O | |
| D. | 该有机物的1个分子里含2个碳原子和6个氢原子,还可能含有氧原子 |
19.明代《本草纲目》记载了民间酿酒的工艺:“凡破坏之酒,皆可蒸烧”,“以烧酒复烧二次,…,价值数倍也”,这里用到的方法可用于分离( )
| A. | 丙烯酸甲酯和甲醇 | B. | 对硝基甲苯和含硝酸的水层 | ||
| C. | 硝酸钾和氯化钠 | D. | 氯化铵和碳酸铵 |
6.短周期主族元素A、B、C、D、E的原子序数依次增大,考古时利用A元素的某种同位素可以测定一些文物的年代,A原子的最外层比B原子的最外层少2个电子,A、B、C三种元素能组成离子化合物C2AB3,B、D同主族.下列说法正确的是( )
| A. | 含氧酸的酸性由强到弱的顺序:E、D、A | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:B、D、E | |
| C. | B、C、E形成的共价化合物CEB可以用来杀菌消毒 | |
| D. | 简单离子半径由大到小的顺序:D、E、B、C |
3.关于生活中的化学问题,下列说法错误的是( )
| A. | 地球上的绝大多数金属元素是以化合态形式存在 | |
| B. | 铜盐溶液都有毒,这主要是由于铜离子能使蛋白质变性 | |
| C. | 普通玻璃以纯碱、石灰石、石英砂为主要原料制得 | |
| D. | SO2气体通入氯水中可以增强氯水溶液的漂白性 |
12.在一定条件下O2与O3可以相互转化,下列说法正确的是( )
| A. | O2和O3互为同素异形体 | |
| B. | O2和O3的相互转化为物理变化 | |
| C. | 等物质的量的O2和O3含有相同的质子数 | |
| D. | 在相同的温度和压强下,等体积的O2和O3含有相同的分子数 |
 .
.
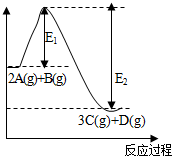 反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:
反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题: