题目内容
7.下列叙述错误的是( )①热稳定性:H2O>HF>H2S ②最外层两个电子的元素,不一定在第IIA族
③IIA族元素的阳离子与上一周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从III 族到IIB族10个纵行的元素都是金属元素
⑤固多电子原子中,在离核较近的区域内运动的电子能量较高
⑥氯的各种含氧酸的酸性由弱到强排列为 HClO<HClO2<HClO3<HClO4
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键.
| A. | ②④⑥ | B. | ①⑤⑥ | C. | ②③④ | D. | ①⑤⑥⑦ |
分析 ①非金属性越强,氢化物的热稳定性越大;
②He最外层含有2个电子,He为0族元素;
③ⅡA族元素的阳离子比同周期稀有气体元素的原子少一个电子层;
④过渡元素都是金属元素;
⑤核外电子中,离核较近的区域内运动的电子能量较低;
⑥Cl元素的化合价越高,对应的氧化物的水化物的酸性越强;
⑦氯化铝为共价化合物,不存在离子键.
解答 解:①非金属性:F>O>S,则氢化物的热稳定性:HF>H2O>H2S,故①错误;
②最外层两个电子的元素,不一定在第IIA族,如He元素,故②正确;
③ⅡA族元素的阳离子比同周期稀有气体元素的原子少一个电子层,与上一周期稀有气体元素的原子具有相同的核外电子排布,故③正确;
④从ⅢB族到ⅡB族10个纵行的元素都是过渡元素,都是金属元素,故④正确;
⑤核外电子中,离核较近的区域内运动的电子能量较低,离核较远的区域内运动的电子能量较高,故⑤错误;
⑥Cl元素的化合价越高,对应的氧化物的水化物的酸性越强,则酸性:HClO4>HClO3>HClO2>HClO,故⑥错误;
⑦两个非金属元素原子间只可能形成共价键,但是含金属元素的化合物中不一定含离子键,如氯化铝为共价化合物,不含离子键,故⑦错误;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,⑦为易错点,注意氯化铝为共价化合物,试题培养了学生的灵活应用能力.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
12.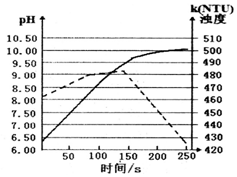 将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
 将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )| A. | 该实验是在常温下进行的 | |
| B. | 实线表示溶液浊度随时间的变化 | |
| C. | 50s时向溶液中滴入酚酞试液,溶液变红 | |
| D. | 150s后溶液浊度下降是因为生成的Mg(OH)2沉降 |
19.明代《本草纲目》记载了民间酿酒的工艺:“凡破坏之酒,皆可蒸烧”,“以烧酒复烧二次,…,价值数倍也”,这里用到的方法可用于分离( )
| A. | 丙烯酸甲酯和甲醇 | B. | 对硝基甲苯和含硝酸的水层 | ||
| C. | 硝酸钾和氯化钠 | D. | 氯化铵和碳酸铵 |
16.下列有关说法中正确的是( )
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离常数K(NH3•H2O)>K(HCN) | |
| B. | 室温时,相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO2-4且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO2-4先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
5.一定温度下,在3个体积均为l.0L的恒容密闭容器中反应2H2(g)+CO(g)?CH3OH(g)分别达到平衡.下列说法正确的是( )
| 容器 | 温度(K) | 起始浓度(mol/L) | CH3OH的平衡浓度(mol/L) | ||
| H2 | CO | CH3OH | |||
| ① | 400 | 0.20 | 0.10 | 0 | 0.08 |
| ② | 400 | 0.40 | 0.20 | 0 | x |
| ③ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应是吸热反应 | |
| B. | X=0.16 | |
| C. | 平衡时,容器②中H2的体积分数比容器①的大 | |
| D. | 400K时若再向容器①中充入0.10molH2、0.10molCO和0.10molCH3OH,则平衡将向正反应方向移动 |
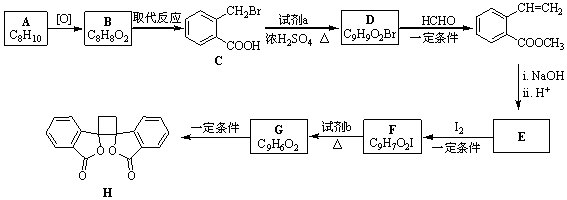
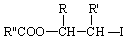
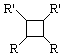
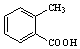 .
.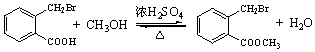 .
. ;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是
;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是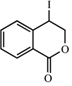 .
.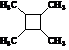 路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).



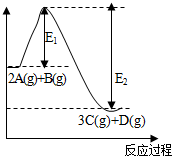 反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:
反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题: