题目内容
14.短周期元素W、X、Y、Z的原子序数依次增大,X、Y、Z的简单离子的电子层结构相同,W与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,Z原子的L层电子数比其最外层电子数多5,W是植物生长不可缺少的三种营养元素之一.下列说法正确的是( )| A. | 单质的沸点:W>X | B. | Y的最高化合价为+7 | ||
| C. | 原子半径:r(W)<r(X)<r(Y)<r(Z) | D. | W、X、能存在于同一离子化合物中 |
分析 短周期元素W、X、Y、Z 的原子序数依次增大,植物生长不可缺少的三种营养元素为N、P、K,W为三者之一,而且原子序数较小,所以W为N元素,Z原子的L层电子数比其最外层电子数多5,则Z的各层上的电子数为2、8、3,所以Z为Al;X、Y、Z的简单离子的电子层结构相同,N与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,则Y为F元素,X为O元素,据此解答.
解答 解:短周期元素W、X、Y、Z 的原子序数依次增大,植物生长不可缺少的三种营养元素为N、P、K,W为三者之一,而且原子序数较小,所以W为N元素,Z原子的L层电子数比其最外层电子数多5,则Z的各层上的电子数为2、8、3,所以Z为Al;X、Y、Z的简单离子的电子层结构相同,N与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,则Y为F元素,X为O元素,
A.W为N元素,X为O元素,单质的沸:O2>N2,故A错误;
B.Y为F元素,没有正化合价,故B错误;
C.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径:r(F)<r(O)<r(N)<r(Al),故C错误;
D.N、O能存在于同一离子化合物中,如硝酸铵,故D正确;
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意利用电子排布的知识和元素在周期表中的位置关系推断元素,对学生的逻辑推理有一定的要求,难度中等.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
4.某无色透明溶液中,下列各组中离子能大量共存的是( )
| A. | NH4+、Na+、Cu2+、NO3- | B. | Na+、Al3+、OH-、Cl- | ||
| C. | Ag+、K+、Cl-、OH- | D. | Na+、H+、NO3-、SO42- |
5.下列物质与其用途相符合的是( )
①Cl2-消毒剂
②Si-半导体材料
③SO2-杀菌消毒
④SiO2-光导纤维
⑤碘-预防甲状腺肿大
⑥淀粉-检验I2的存在
⑦Ca(ClO)2-漂白纺织物
⑧Al2O3-耐高温材料.
①Cl2-消毒剂
②Si-半导体材料
③SO2-杀菌消毒
④SiO2-光导纤维
⑤碘-预防甲状腺肿大
⑥淀粉-检验I2的存在
⑦Ca(ClO)2-漂白纺织物
⑧Al2O3-耐高温材料.
| A. | ②③④⑤⑥⑧ | B. | ①②③④⑤⑧ | C. | ②③④⑤⑧ | D. | 全部 |
2.下列有关实验的说法正确的是( )
| A. | 向含少量苯酚的苯中加入适量溴水后过滤,可除去苯酚 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN溶液,溶液变成血红色,说明该溶液中一定含有Fe3+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明Fe2+是被HClO所氧化 |
9.宋代《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是 4Ag+2H2S+O2→2X+2H2O,下列说法正确的是( )
| A. | X的化学式为AgS | B. | 银针验毒时,空气中氧气失去电子 | ||
| C. | 反应的还原剂是H2S | D. | 每生成1mo1X转移2mo1电子 |
19.科技人员研究“变害为宝”的途径,以NO为原料通过电解制备NH4NO3.其工作原理如图所示,下列有关说法错误的是( )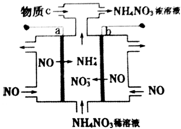

| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
6.用下列气体和液体进行喷泉实验,最终液体一定不能充满烧瓶的是( )
| A. | NO2、O2混合气体和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | NO2和H2O |
4.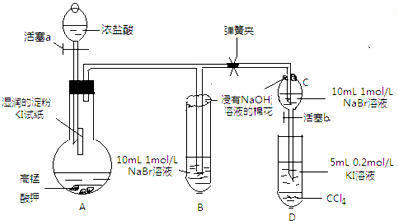 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
实验方案:该小组设计如图所示装置实验(夹持仪器已略去,装置气密性完好)
实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
 ,C的官能团名称醇羟基.
,C的官能团名称醇羟基. .
. .
.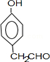 .
.