题目内容
9.用惰性电极电解饱和的NaCl溶液,将湿润的淀粉KI试纸放在阳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去.这是因为过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,该反应的化学方程式为5Cl2+I2+6H2O═2HIO3+10HCl.分析 用惰性电极电解饱和的NaCl溶液,阳极上氯离子放电生成氯气,将湿润的淀粉KI试纸放在阳极附近,发现试纸变蓝,说明氯气将碘离子氧化生成碘;待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据转移电子守恒知,氯气被还原为-1价、碘被氧化为+5价,则两种酸分别是HCl、HIO3,根据反应物和生成物书写方程式.
解答 解:用惰性电极电解饱和的NaCl溶液,阳极上氯离子放电生成氯气,将湿润的淀粉KI试纸放在阳极附近,发现试纸变蓝,说明氯气将碘离子氧化生成碘;待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据转移电子守恒知,氯气被还原为-1价、碘被氧化为+5价,则两种酸分别是HCl、HIO3,根据反应物和生成物书写方程式为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O═2HIO3+10HCl.
点评 本题以化学方程式的书写为载体考查氧化还原反应,为高频考点,正确判断碘中氧化产物中的化合价是解本题关键,知道氧化还原反应中转移电子守恒,题目难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能够发生 | |
| C. | 反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热 | |
| D. | 化学反应才有伴随能量变化,物理变化没有伴随能量变化 |
17.下列物质中,不能与SiO2反应的是( )
| A. | NaOH | B. | CaO | C. | 氢氟酸 | D. | H2O |
4.某无色透明溶液中,下列各组中离子能大量共存的是( )
| A. | NH4+、Na+、Cu2+、NO3- | B. | Na+、Al3+、OH-、Cl- | ||
| C. | Ag+、K+、Cl-、OH- | D. | Na+、H+、NO3-、SO42- |
14.下列物质中,摩尔质量最大的是( )
| A. | 10mL H2O | B. | 0.8mol H2SO4 | C. | 54g Al | D. | 1gCaCO3 |
19.科技人员研究“变害为宝”的途径,以NO为原料通过电解制备NH4NO3.其工作原理如图所示,下列有关说法错误的是( )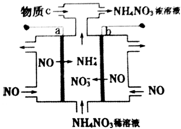

| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:
在容积为2L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题: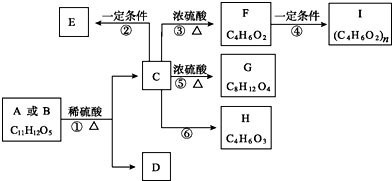
 .
.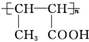 b.D在一定条件下也可以反应形成高聚物
b.D在一定条件下也可以反应形成高聚物 .
. .
.