题目内容
7.你被遗忘在火星上,如何生存下去等待救援呢?(1)获得氢气.向火箭燃料液态联氨(N2H4)中加入铱催化剂,分解生成氮气和氢气.
已知:3N2H4(l)?4NH3(g)+N2(g)△H=-336.6kJ•mol-1
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
则N2H4(g)?N2(g)+2H2(g)△H=-50.6kJ•mol-1,该反应平衡常数的表达式为K=$\frac{{[N}_{2}][{H}_{2}]^{2}}{[{N}_{2}{H}_{4}]}$.
(2)获得氧气.火星大气中有稀薄的CO2.
以碱溶液为电解质可实现如下转化2CO2$\frac{\underline{\;电解\;}}{\;}$2CO+O2,该反应在一定条件下能自发进行的原因是△S>0,阴极的反应式为2CO2+4e-+2H2O=2CO+4OH-.
(3)获得水.火星上含有高浓度高氯酸根的有毒卤水,可对其进行生物降解.
Ⅰ、在微生物的催化下,ClO4-可被CH3COO-还原,过程如图1所示,CH3COO-也可作为碳元素的来源,促进微生物生长.
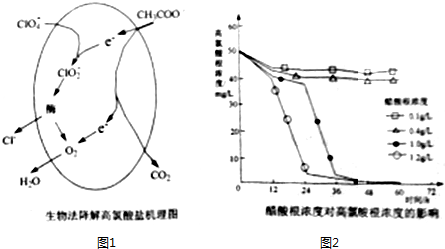
①该过程中总反应的离子方程式为ClO4-+CH3COO-+H+=2CO2+2H2O+Cl-,.
②CH3COO-的浓度对ClO4-降解程度的影响如图2所示,则12小时后,CH3COO-浓度小于0.4g/L的条件下,ClO4-的降解几乎停滞的原因是CH3COO-浓度过低,不能促进微生物生长,失去催化作用,反应速率显著降低.
Ⅱ.高氯酸、盐酸和硝酸的酸性在水溶液中差别不大.某温度下,这三种酸在冰醋酸中的电离平衡常数如表所示.冰醋酸做溶剂,这三种酸酸性最强的是HClO4.在冰醋酸中,盐酸的电离方程式为HCl?H++Cl-.
| 酸 | HClO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 1.6×10-9 | 4.2×10-10 |
分析 (1)已知:①3N2H4(l)?4NH3(g)+N2(g)△H=-336.6kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
则①×$\frac{1}{3}$-②×$\frac{2}{3}$得到N2H4(g)?N2(g)+2H2(g),据盖斯定律来计算;平衡常数K=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$;
(2)电解池可以实现分自发的氧化还原反应的发生,根据自发进行的判据△H-T△S<0来判断;在电解池的阴极上发生得电子的还原反应,据此回答;
(3)Ⅰ、①微生物的催化下,ClO4-可被CH3COO-还原,得到二氧化碳和氯离子,据此书写离子方程式;
②根据CH3COO-的浓度对ClO4-降解程度的影响图可以看出:CH3COO-浓度过低,不能促进微生物生长;
Ⅱ、电离平衡常数越大,酸的电离程度越大,酸性越强;在冰醋酸中,盐酸不能完全电离,据此回答.
解答 解:(1)已知:①3N2H4(l)?4NH3(g)+N2(g)△H=-336.6kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
据盖斯定律,则①×$\frac{1}{3}$-②×$\frac{2}{3}$得到N2H4(g)?N2(g)+2H2(g),所以
△H=(-336.6kJ•mol-1)×$\frac{1}{3}$-$\frac{2}{3}$(-92.4kJ•mol-1)=-50.6kJ•mol-1,平衡常数K=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$=$\frac{{[N}_{2}][{H}_{2}]^{2}}{[{N}_{2}{H}_{4}]}$,
故答案为:-50.6;K=$\frac{{[N}_{2}][{H}_{2}]^{2}}{[{N}_{2}{H}_{4}]}$;
(2)转化2CO2$\frac{\underline{\;通电\;}}{\;}$2CO+O2是一个熵增加的反应,有利于自发进行;在电解池的阴极上发生得电子的还原反应,阴极的反应式为:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:△S>0;2CO2+4e-+2H2O=2CO+4OH-;
(3)Ⅰ、①微生物的催化下,ClO4-可被CH3COO-还原,得到二氧化碳和氯离子,离子方程式为:ClO4-+CH3COO-+H+=2CO2+2H2O+Cl-,故答案为:ClO4-+CH3COO-+H+=2CO2+2H2O+Cl-;
②根据CH3COO-的浓度对ClO4-降解程度的影响图可以看出:CH3COO-浓度过低,不能促进微生物生长CH3COO-浓度小于0.4g/L的条件下,ClO4-的降解几乎停滞,故答案为:CH3COO-浓度过低,不能促进微生物生长,失去催化作用,反应速率显著降低;
Ⅱ、电离平衡常数越大,酸的电离程度越大,酸性越强,所以这三种酸酸性最强的是HClO4;在冰醋酸中,盐酸不能完全电离,电离方程式为:HCl?H++Cl-.
故答案为:HClO4;HCl?H++Cl-.
点评 本题综合考查学生盖斯定律的应用、电解池的工作原理以及弱电解质的电离等方面的知识,属于综合知识的考查,注意知识的迁移应用是关键,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | NaOH | B. | CaO | C. | 氢氟酸 | D. | H2O |
| A. | 3.1g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1mol丙烯醛中含有双键的数目为0.1NA | |
| C. | 标准状况下,2.24L乙醇中含有的分子数目为0.1NA | |
| D. | 0.1mol的氯气全部溶于水后转移电子的数目为0.1NA |
| A. | 向含少量苯酚的苯中加入适量溴水后过滤,可除去苯酚 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN溶液,溶液变成血红色,说明该溶液中一定含有Fe3+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明Fe2+是被HClO所氧化 |
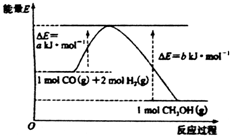
| A. | 该反应的活化能为a kJ•mol-1 | |
| B. | 1mol CO(g)和2 mol H2(g)的能量和大于1mol CH3OH(g)的能量 | |
| C. | 该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=(a-b)kJ•mol-1 | |
| D. | CO(g)+2H2(g)=CH3OH(1)△H=c kJ•mol-1c>(a-b) |
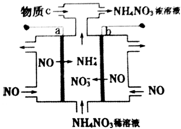
| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
| A. | CH3Cl  | B. | 2-氯甲苯的结构简式: | ||
| C. | 硝基苯的结构简式  | D. | CH4分子的球棍模型: |
①铁 ②镁 ③锰 ④钒 ⑤铬.
| A. | ①②④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |