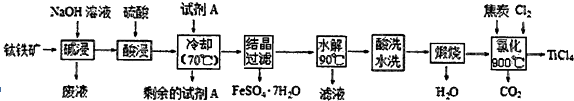
题目内容
1.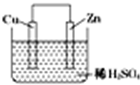 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( ) ②SO42-向正极移动
③电子是由Zn经外电路流向Cu
④Zn极上有H2产生
⑤若有1mol电子流经导线,则可产生的H2为0.5mol
⑥负极的电极反应式为Zn-2e-=Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ③⑤⑥ | D. | ②③⑥ |
分析 Zn-Cu原电池中,Zn作负极,发生电池反应Zn+2H+=Zn2++H2↑,电子由负极流向正极,阳离子向正极移动,以此来解答.
解答 解:①Zn为负极,Cu为正极,故①错误;
②H+向正极移动,SO42-向负极移动,故②错误;
③电子由Zn电极经外电路流向Cu电极,故③正确;
④Cu电极上发生2H++2e-=H2↑,故④错误;
⑤由2H++2e-=H2↑可知,有1mol电子流向导线,产生氢气0.5mol,故⑤正确;
⑥正极反应为2H++2e-=H2↑,负极的电极反应式为Zn-2e-=Zn2+,故⑥正确;
故选C.
点评 本题考查原电池,明确电极的判断、发生的电极反应、电子、离子的移动方向即可解答,题目难度不大.

练习册系列答案
相关题目
13.下列各组物质,互称为同系物的一组是( )
| A. | O2和O3 | B. | CH3CH3和CH3CH2CH2CH3 | ||
| C. | H和D | D. | 正丁烷和异丁烷 |
12.下列有关实验操作或现象描述正确的是( )
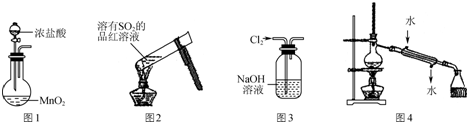

| A. | 实验室用图1装置制备Cl2 | |
| B. | 加热后图2中溶液颜色恢复红色 | |
| C. | 用图3装置除去Cl2中含有的少量HCl | |
| D. | 实验室用图4装置制取少量蒸馏水 |
9.下列物质中既能发生水解反应又能发生消去反应,且消去反应的产物只有一种的是( )
| A. |  | B. |  | C. | CH3Cl | D. |  |
16.下列说法正确的是( )
| A. | 苯酚有毒,不可以作消毒剂和防腐剂 | |
| B. | 橙色的K2Cr2O7酸性水溶液遇到乙醇迅速生成蓝绿色Cr3+是由于乙醇有还原性 | |
| C. | 所有卤代烃均可以发生消去反应和水解反应 | |
| D. | 用食醋去除水壶中的水垢时所发生的是水解反应 |
6.某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )
①第二周期 ②第三周期 ③ⅣA族 ④ⅤA族.
①第二周期 ②第三周期 ③ⅣA族 ④ⅤA族.
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
13.下列化学用语正确的是( )
| A. | N2的电子式: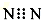 | B. | H2O2的电子式 | ||
| C. | 氨分子的结构式 | D. | 14C的原子结构示意图 |

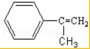 ;
;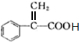 ;
;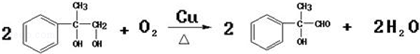 ;
;