题目内容
下列叙述中正确的是( )
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
考点:电解原理,反应热和焓变,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:基本概念与基本理论
分析:A、电解法精炼铜时,以粗铜作阳极,纯铜作阴极;
B、依据氢氧化铁胶体制备方法分析判断;
C、溶液中存在离子积常数,稀释溶液,氢氧根离子浓度减小,氢离子浓度增大;
D、依据反应自发进行的判断依据△H-T△S<0分析;
B、依据氢氧化铁胶体制备方法分析判断;
C、溶液中存在离子积常数,稀释溶液,氢氧根离子浓度减小,氢离子浓度增大;
D、依据反应自发进行的判断依据△H-T△S<0分析;
解答:
解:A、依据电解原理分析判断,电解法精炼铜时,以粗铜作阳极,纯铜作阴极,故A错误;
B、依据氢氧化铁胶体制备方法分析,向沸水中滴加FeCl3饱和溶液加热到红褐色得到Fe(OH)3胶体,故B正确;
C、溶液中存在离子积常数,稀释溶液,氢氧根离子浓度减小,氢离子浓度增大,故C错误;
D、依据反应自发进行的判断依据△H-T△S<0分析,反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,△H-T△S<0,反应前后气体体积减小,△S<0,则该反应的△H<0,故D正确;
故选BD.
B、依据氢氧化铁胶体制备方法分析,向沸水中滴加FeCl3饱和溶液加热到红褐色得到Fe(OH)3胶体,故B正确;
C、溶液中存在离子积常数,稀释溶液,氢氧根离子浓度减小,氢离子浓度增大,故C错误;
D、依据反应自发进行的判断依据△H-T△S<0分析,反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,△H-T△S<0,反应前后气体体积减小,△S<0,则该反应的△H<0,故D正确;
故选BD.
点评:本题考查了电解原理、胶体制备、弱电解质溶液稀释,反应自发进行的判断依据,掌握基础是关键,注意溶液稀释过程中离子浓度变化,题目较简单.

练习册系列答案
相关题目
在由水电离出的c(H+)=1×10-13 mol/L的溶液中,一定可以大量共存的是( )
| A、Ba2+ Na+ NO3- Cl- |
| B、Fe2+ Na+ NO3- Cl- |
| C、SO42- S2O32- NH4+ Na+ |
| D、Mg2+ Na+ Br- AlO2- |
人类社会需要科学发展.下列做法科学合理的是( )
| A、在田间焚烧秸秆,增加草木灰肥料 |
| B、大量开采地下水,以满足生产、生活的需求 |
| C、用“复合石头纸”替代木浆纸,减少树木砍伐 |
| D、尽可能多的使用各种添加剂,改善食品的品质 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、某无色溶液中:Al3+、Cu2+、SO42-、Cl- |
| B、由水电离的c(H+)=1×10-12 mol?L-1的溶液中:Ba2+、K+、Cl-、NO3- |
| C、c(OH-)/c(H+)=1012的溶液中:Na+、Mg2+、NO3-、Cl- |
| D、加入铝单质能放出氢气的溶液中:Mg2+、NH4+、Cl-、K+ |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、氯化铁溶液与氢氧化钠溶液:Fe3++3OH-═Fe(OH)3↓ |
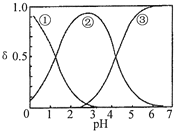 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )| A、曲线①代表的粒子是HC2O4- |
| B、0.1 mol?L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D、一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
化学兴趣小组利用如图装置进行电化学实验,下列预期现象正确的是( )


| A、X和Y与电流表连接,将Zn换成Fe,测得电流更大 |
| B、X和Y与电流表连接,将盐桥换成铜线,电流表指针偏转 |
| C、X和Y分别与电源“+”、“-”极相连,Cu极质量增大 |
| D、X和Y分别与电源“-”、“+”极相连,盐桥中阴离子向Zn极移动 |
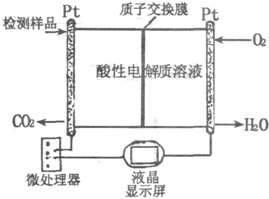 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.