题目内容
3. 请回答下列问题:
请回答下列问题:(1)有以下几种物质①NaCl晶体 ②液态氯化氢 ③铜丝 ④SiO2 ⑤NH3 ⑥KNO3溶液填空回答(填序号):以上物质中能导电的是③⑥;属于电解质的是①②;属于非电解质的是④⑤;上述纯净物中含有共价键的是②④⑤;既不是电解质也不是非电解质的是③⑥.
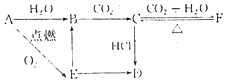
(2)A、B、C、D、E、F六种物质含有同一种元素,六种物质的相互转化关系如图,E是淡黄色粉末,判断:写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
B→C:2OH-+CO2=CO32-+H2O; E→B:2Na2O2+2H2O=4Na++4OH-+O2↑;C→F:CO32-+H2O+CO2=2HCO3-; F→C:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
分析 (1)电解质在水溶液中或熔融状态下能够导电,是因为电解质自身可以电离出自由移动的离子,金属导电是因为自由移动的电子;
电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
共价键是原子间以共用电子对形成的化学键,分子构成的物质是指含分子的纯净物;
单质和混合物既不是电解质也不是非电解质;
(2)A与氧气反应生成淡黄色粉末E为Na2O2,则A为Na,钠与水反应生成B且也能由过氧化钠转化得到,可推知B为NaOH,由于NaOH与二氧化碳得到C,C与二氧化碳、水反应得到F,可推知C为Na2CO3、F为NaHCO3,碳酸钠与HCl反应得到固体D,且能由过氧化钠转化得到,可推知D为NaCl,据此解答.
解答 解:以上物质中能导电的是③铜丝是金属存在自由移动的电子,⑥KNO3溶液中存在自由移动的离子,能导电,
属于电解质的是①NaCl晶体 ②液态氯化氢,氯化钠晶体和氯化氢溶于水都能电离出离子,溶液能导电,NaCl晶体和液态氯化氢属于电解质,
属于非电解质的是④SiO2 ⑤NH3,二氧化硅和氨气本身都不能电离出离子,属于非电解质,
上述纯净物中含有共价键的是②液态氯化氢,氯原子和氢原子形成共价键,④SiO2,硅原子和氧原子间形成的是共价键,⑤NH3 氮原子和氢原子间形成的化学键是共价键,
既不是电解质也不是非电解质的是③⑥
故答案为:③⑥;①②;④⑤;②④⑤;③⑥.
(2)A与氧气反应生成淡黄色粉末E为Na2O2,则A为Na,钠与水反应生成B且也能由过氧化钠转化得到,可推知B为NaOH,由于NaOH与二氧化碳得到C,C与二氧化碳、水反应得到F,可推知C为Na2CO3、F为NaHCO3,碳酸钠与HCl反应得到固体D,且能由过氧化钠转化得到,可推知D为NaCl,
由上述分析可知,A为Na,D为NaCl,故答案为:Na;NaCl;
B→C是氢氧化钠与二氧化碳反应生成碳酸钠与水,反应离子方程式为:2OH-+CO2=CO32-+H2O,
E→B是过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
C→F是碳酸钠与二氧化碳、水反应生成碳酸氢钠,反应离子方程式为:CO32-+H2O+CO2=2HCO3-,
F→C是碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2OH-+CO2=CO32-+H2O;2Na2O2+2H2O=4Na++4OH-+O2↑;CO32-+H2O+CO2=2HCO3-,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查物质的导电性、电解质、非电解质概念的辨析、物质形成化学键和构成微粒的判断、无机物推断,涉及钠元素单质及其化合物的转化,突破口为“E为淡黄色粉末及由A与氧气在点燃条件下得到”,再结合转化关系推断,题目难度中等,注意基础知识的掌握.

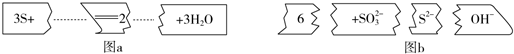
| A. | 配平后的化学计量数依次为3、1、2、6、3 | |
| B. | 若有1 mol S被氧化,则生成2 mol S2- | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 2 mol S参加反应有3 mol电子发生转移 |
| A. | SO2和SO3互为同分异构体 | |
| B. | 二氧化碳和干冰互为同素异形体 | |
| C. | CH3CH2OH和 CH3-O-CH3 互为同分异构体 | |
| D. | 红磷和白磷互为同位素 |
| A. | 甲烷和氯气光照 | B. | 氯乙烯的加聚 | ||
| C. | 丙烯和氯化氢加成 | D. | 乙烯和水加成 |
| A. | 升高温度,B的百分含量增加 | |
| B. | 当容器中气体的密度不变时,反应达到平衡 | |
| C. | 加入少量K,逆反应速率增大 | |
| D. | 平衡后加入A,上述反应的△H增大 |
| A. | 乙烷的二氯代物和丙烷的一氯代物 | |
| B. | 正丁烷的一氯代物和异戊烷的一氯代物 | |
| C. | 新戊烷的一氯代物和C(CH2CH3)4的一氯代物 | |
| D. | C2H6的五氯代物和C5H8属于炔烃的同分异构体数目 |
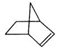 ,降冰片烯在一定的条件下可以转化为降冰片烷(如图所示):
,降冰片烯在一定的条件下可以转化为降冰片烷(如图所示): ,则降冰片烷的二氯取代物共有10种.
,则降冰片烷的二氯取代物共有10种.
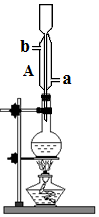 将无水乙醇、冰醋酸、浓硫酸放入烧瓶中,并加入沸石,加热一段时后,再更换装置可蒸馏出乙酸乙酯.
将无水乙醇、冰醋酸、浓硫酸放入烧瓶中,并加入沸石,加热一段时后,再更换装置可蒸馏出乙酸乙酯.