题目内容
4.0.1mol/LNa2S溶液,下列说法正确的是( )| A. | c(Na+)=2c(S2-) | B. | c(OH-)=c(H+)+c(HS-)+2c(H2S) | ||
| C. | c(Na+)>c(S2-)>c(HS-)>c(OH-) | D. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) |
分析 0.1mol/LNa2S溶液中存在硫离子的水解,即S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,结合溶液中电荷守恒和物料守恒分析.
解答 解:A.0.1mol/LNa2S溶液中,硫离子发生水解,则c(Na+)>2c(S2-),故A错误;
B.溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),物料守恒为c(Na+)=2c(S2-)2c(HS-)+2c(H2S),则c(OH-)=c(H+)+c(HS-)+2c(H2S),故B正确;
C.硫离子的水解,即S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,则c(OH-)>c(HS-),所以c(Na+)>c(S2-)>c(OH-)>c(HS-),故C错误;
D.溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故D错误.
故选B.
点评 本题考查了影响盐类水解的因素,难度不大,注意把握溶液中的守恒关系,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.某温度下,体积一定的密闭容器中进行如下可逆反应:A(g)+B(g)?P(g)+K(s)△H>0.下列叙述正确的是( )
| A. | 升高温度,B的百分含量增加 | |
| B. | 当容器中气体的密度不变时,反应达到平衡 | |
| C. | 加入少量K,逆反应速率增大 | |
| D. | 平衡后加入A,上述反应的△H增大 |
12.下列各组指定物质的同分异构体数目相等的是( )
| A. | 乙烷的二氯代物和丙烷的一氯代物 | |
| B. | 正丁烷的一氯代物和异戊烷的一氯代物 | |
| C. | 新戊烷的一氯代物和C(CH2CH3)4的一氯代物 | |
| D. | C2H6的五氯代物和C5H8属于炔烃的同分异构体数目 |
19.在由Fe、FeO、和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是( )
| A. | 混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:1 | |
| C. | 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 | |
| D. | 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
9.下列装置或操作不能达到实验目的是( )
| A. |  比较 Cl2、Fe3+、I2的氧化性 | B. |  制取 Fe(OH)2 制取 Fe(OH)2 | ||
| C. | 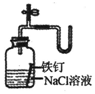 证明铁生锈时空气参加反应 | D. | 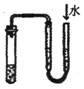 检查装置气密性 |
14.在生产、生活中,下列物质起到氧化作用的是( )
| A. | 甘油用作护肤保湿剂 | |
| B. | 高锰酸钾溶液用于水果保鲜 | |
| C. | 铁粉用作食品袋中的脱氧剂 | |
| D. | 浓盐酸用于检验输送氨气管道是否漏气 |
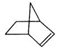 ,降冰片烯在一定的条件下可以转化为降冰片烷(如图所示):
,降冰片烯在一定的条件下可以转化为降冰片烷(如图所示): ,则降冰片烷的二氯取代物共有10种.
,则降冰片烷的二氯取代物共有10种.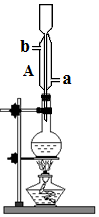 将无水乙醇、冰醋酸、浓硫酸放入烧瓶中,并加入沸石,加热一段时后,再更换装置可蒸馏出乙酸乙酯.
将无水乙醇、冰醋酸、浓硫酸放入烧瓶中,并加入沸石,加热一段时后,再更换装置可蒸馏出乙酸乙酯.