题目内容
9.已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.下列结论正确的是( )
| A. | ①②③均是氧化还原反应 | |
| B. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| C. | 氧化性强弱顺序是:K2Cr2O7>I2>Fe2(SO4)3 | |
| D. | 反应③中0.1mol还原剂共失去电子数为0.5NA |
分析 ①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,该反应中元素的化合价不变,不属于氧化还原反应;
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,Cr元素的化合价降低,Fe元素的化合价升高,为氧化还原反应;
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4中,Fe元素的化合价降低,I元素的化合价升高,为氧化还原反应,结合化合价变化及氧化剂的氧化性大于氧化产物的氧化物来解答.
解答 解:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,该反应中元素的化合价不变,不属于氧化还原反应;
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,Cr元素的化合价降低,Fe元素的化合价升高,为氧化还原反应;
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4中,Fe元素的化合价降低,I元素的化合价升高,为氧化还原反应,
A.②③属于氧化还原反应,而①不属于氧化还原反应,故A错误;
B.②中氧化剂为K2Cr2O7,还原剂为FeSO4,氧化剂与还原剂的物质的量之比为1:6,故B正确;
C.由②③中氧化剂的氧化性大于氧化产物的氧化性可知,氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2,故C错误;
D.③中还原剂为HI,则0.1mol还原剂共失去电子数为NA,故D错误;
故选B.
点评 本题考查氧化还原反应及计算,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中转移电子及计算的考查,题目难度不大.

练习册系列答案
相关题目
15.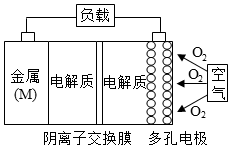 已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
 已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )| A. | 该电池的放电过程的正极反应为O2+4e-+2H2O=4OH- | |
| B. | 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极 | |
| D. | 与铝一空气电池相比,镁一空气电池的比能量更高 |
16.不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9ClO的同分异构体中能与Na反应放出氢气的共有 ( )
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
13.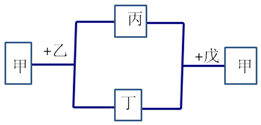 短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )| A. | 简单离子的半径大小X<Y<Z | |
| B. | 化合物乙中含离子键和非极性共价键 | |
| C. | W与Z形成的化合物常温常压下呈液态 | |
| D. | 图中生成甲的离子方程式为6H++SO32-+2S2-=3S↓+3H2O |
4.科学家在利用无土栽培培养一些名贵花卉时,培养液中添加了多种必需元素,其配方如下,其中植物根吸收最少的离子是( )
| 离子 | K+ | Mg2+ | Ca2+ | NO3- | H2PO4- | SO42- | Zn2+ |
| $\frac{培养液浓度}{nmol•{L}^{-1}}$ | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
| A. | Zn2+ | B. | SO42- | C. | Ca2+ | D. | H2PO4- |
14.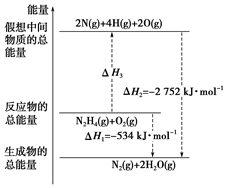 肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )
 肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )| A. | 194 | B. | 391 | C. | 516 | D. | 685 |
1.已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题:
(1)表中硫酸的质量分数为$\frac{98{c}_{1}}{1000{ρ}_{1}}$(不写单位,用含c1、ρ1的代数式表示).
(2)物质的量浓度为c1mol•L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为0.5c1mol•L-1.
(3)物质的量浓度为c2mol•L-1的氨水与$\frac{1}{5}$c2mol•L-1的氨水等质量混合,所得溶液的密度大于(填“大于”、“小于”或“等于”,下同) ρ2g•cm-3,所得溶液的物质的量浓度大于$\frac{3}{5}$c2mol•L-1(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式NH3•H2O+H+=NH4++H2O.
| 溶质的物质的量浓度/mol•L-1 | 溶液的密度/g•cm-3 | 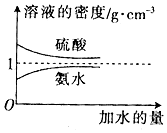 | |
| 硫酸 | c1 | ρ1 | |
| 氨水 | c2 | ρ2 |
(2)物质的量浓度为c1mol•L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为0.5c1mol•L-1.
(3)物质的量浓度为c2mol•L-1的氨水与$\frac{1}{5}$c2mol•L-1的氨水等质量混合,所得溶液的密度大于(填“大于”、“小于”或“等于”,下同) ρ2g•cm-3,所得溶液的物质的量浓度大于$\frac{3}{5}$c2mol•L-1(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式NH3•H2O+H+=NH4++H2O.
19.下列各组物质的变化,不能用平衡移动原理解释的是( )
| A. | 打开啤酒盖,立即有气体逸出 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | NO2和N2O4的混合体系,压缩容器体积,颜色变深 | |
| D. | 工业生产硫酸的过程中使用过量的O2,以提高SO2的转化率 |