题目内容
11.下列关于氟氯烃的说法不正确的是( )| A. | 氟氯烃是一类含氟和氯的卤代烃 | |
| B. | 氟氯烃的化学性质不稳定,有毒 | |
| C. | 氟氯烃大多数无色、无臭、无毒 | |
| D. | 在平流层,氟氯烃在紫外线照射下,分解产生的氯原子可引发损耗O3的循环反应 |
分析 氟氯烃是一类含氟和氯的卤代烃,它化学性质稳定,大多无色、无臭、无毒,所以它被广泛应用于制冷业,但是释放到空气中的氟氯烃,可以到达大气平流层,并且在紫外线作用下,分解产生氯原子,从而引发损耗臭氧的循环反应,造成臭氧层空洞,使大量的紫外线照向大地,伤害地球上的生物,据此分析解答.
解答 解:A.氟氯烃分子中多个氢原子被氟、氯取代得到的产物,故A正确;
B.氟氯烃在紫外线照射下,分解产生氯原子从而引发损耗臭氧的循环反应,造成臭氧层空洞,使大量的紫外线照向大地,伤害地球上的生物,但无毒,故B错误;
C.氟氯烃大多数无色,无臭,无毒,故C正确;
D.在平流层,氟氯烃在紫外线照射下,分解产生氯原子可引发损耗O3的循环反应,故D正确;
故选B.
点评 本题考查了氟氯烃的结构与性质,属于对基础知识的考查,明确氟氯烃能够破坏大气臭氧层是解题关键,注意相关知识的积累.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
1.把0.1mol MgCl2固体溶于水配成100mL溶液,此溶液中Cl-的物质的量浓度为( )
| A. | 3.Omol•L-1 | B. | 2.Omol•L-1 | C. | O.3mol•L-1 | D. | O.2mol•L-1 |
2.在一定条件下,可与苯发生反应的是( )
| A. | 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 浓硫酸和浓硝酸的混合物 | D. | 氯化氢 |
1.(1)已知在常温常压下:
①2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(I)△H=-44.0kJ/mol
请写出1mol甲醇不完全燃烧生成1mol一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图1装置模拟上述过程:

①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为:6Co3++CH3OH+H2O═CO2↑+6Co2++6H+.该过程中被氧化的元素是碳,当产生标准状况下2.24LCO2时,共转移电子0.6mol.
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如图2所示.0.50mol/LNaOH溶液50mL和0.50mol/L硫酸溶液30mL进行实验,实验数据如表所示.
①请写下表中的空白.
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值与57.3kJ/mol有偏差,产生偏差的原因可能是acd.
a.实验装置保湿或隔热效果差 b.用量筒量取NaOH溶液的体积时俯视读数
c.用环形铜丝搅拌棒搅拌溶液 d用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
①2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(I)△H=-44.0kJ/mol
请写出1mol甲醇不完全燃烧生成1mol一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图1装置模拟上述过程:

①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为:6Co3++CH3OH+H2O═CO2↑+6Co2++6H+.该过程中被氧化的元素是碳,当产生标准状况下2.24LCO2时,共转移电子0.6mol.
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如图2所示.0.50mol/LNaOH溶液50mL和0.50mol/L硫酸溶液30mL进行实验,实验数据如表所示.
①请写下表中的空白.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t℃/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值与57.3kJ/mol有偏差,产生偏差的原因可能是acd.
a.实验装置保湿或隔热效果差 b.用量筒量取NaOH溶液的体积时俯视读数
c.用环形铜丝搅拌棒搅拌溶液 d用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
6.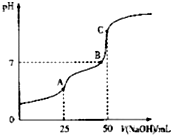 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有NaHC2O4和Na2C2O4 | |
| C. | A点时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | C点时,c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |