题目内容
铜和浓硫酸发生反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
(1)浓H2SO4具有 性.
(2)在该反应中,若消耗了32g Cu,则转移了 mol 电子,还原了 mol H2SO4,生成 L SO2(标准状况)气体.
| ||
(1)浓H2SO4具有
(2)在该反应中,若消耗了32g Cu,则转移了
考点:氧化还原反应,浓硫酸的性质
专题:氧化还原反应专题
分析:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中,Cu元素的化合价升高,S元素的化合价降低,结合元素的化合价变化计算.
| ||
解答:
解:(1)S元素的化合价降低生成二氧化硫,体现其氧化性,生成硫酸铜体现其酸性,故答案为:氧化性和酸;
(2)消耗了32g Cu,则转移了
×(2-0)=1mol电子,由反应可知0.5molCu还原0.5molH2SO4,生成0.5molSO2,其体积为0.5mol×22.4L/mol=11.2L,
故答案为:1;0.5;11.2.
(2)消耗了32g Cu,则转移了
| 32g |
| 64g/mol |
故答案为:1;0.5;11.2.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化即可解答,题目难度不大,侧重氧化还原反应基本概念及电子转移计算的考查,注意从元素化合价角度分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关比较中,大小顺序排列错误的是( )
| A、沸点:NH3>PH3>AsH3 |
| B、熔点:石英>食盐>干冰 |
| C、结合质子的能力:CO32->CH3COOˉ>SO42- |
| D、热稳定性:HF>HCl>HBr>HI |
下列说法正确的是( )
| A、酸性:HClO4<H2SO4<H3PO4 |
| B、稳定性:HF>HCl>HBr |
| C、原子半径:C>N>P |
| D、碱性:NaOH>KOH>Ca(OH)2 |
下列说法正确的是( )
| A、阴极射线、α-粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献 |
| B、纤维素、PLA、纤维二糖、天然油脂、硝化纤维等都是高分子化合物 |
| C、高容量储氢材料的研制是推广应用氢氧燃料电池的关键问题之一 |
| D、硫、白磷、臭氧、碳-60、氩、水等物质固态时都是分子晶体,分子内都存在共价键 |
下列说法正确的是( )
| A、根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 |
| B、CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 |
| C、Na2O的水溶液能导电,所以Na2O是电解质 |
| D、在熔化状态下能导电的化合物为离子化合物 |
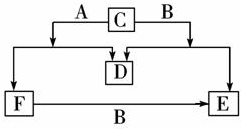 A、B、C、D、E、F六种物质中除D为气体单质外其余均为常见的化合物,E和F的水溶液均呈碱性,且都为重要的化工原料,其焰色反应为黄色,它们的转化关系如图所示.请回答下列问题:
A、B、C、D、E、F六种物质中除D为气体单质外其余均为常见的化合物,E和F的水溶液均呈碱性,且都为重要的化工原料,其焰色反应为黄色,它们的转化关系如图所示.请回答下列问题:
