题目内容
5.参考表中物质的熔点,回答有关问题.| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与相对分子质量有关,随着此值的增大,分子间作用力增大,故熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与晶体类型有关.
分析 (1)离子晶体中离子的半径越小,离子键强度越大,熔点越高;
(2)分子晶体的熔点与分子间作用力有关,相对分子质量越大,分子间作用力越强,熔点越高,所以硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与相对分子质量有关,随着相对分子质量增大,分子间作用力增强;
(3)一般离子晶体的熔点比分子晶体的熔点高.
解答 解:(1)离子晶体中离子的半径越小,离子键强度越大,熔点越高,所以钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的半径有关,随着半径的增大,熔点逐渐降低;故答案为:离子半径大小;
(2)分子晶体的熔点与分子间作用力有关,相对分子质量越大,分子间作用力越强,熔点越高,所以硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与相对分子质量有关,随着相对分子质量增大,分子间作用力增强,故熔点逐渐升高,故答案为:相对分子质量;分子间作用力;
(3)一般离子晶体的熔点比分子晶体的熔点高,因为钠的卤化物为离子晶体,硅的卤化物为分子晶体,所以故前者的熔点远高于后者,故答案为:晶体类型.
点评 本题考查了晶体类型与晶体熔点的关系,根据影响晶体熔点的因素分析,题目难度不大.

练习册系列答案
相关题目
15.某非金属元素在化学反应中从化合态变为游离态,则该元素( )
| A. | 一定被氧化 | B. | 一定被还原 | ||
| C. | 可能被氧化,也可能被还原 | D. | 化合价升高为O |
16.下列离子方程式正确的是( )
| A. | HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | |
| C. | 过量的CO2通入NaOH溶液中:CO2-+2OH-=CO32-+H2O | |
| D. | 新制氢氧化铜(碱性)和乙醛反应:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ CH3COOH+Cu2O↓+2H2O |
13.下列物质的分类合理的是( )
| A. | 氧化物:NO、CO2、SO2、Na2O2 | |
| B. | 碱:NaOH、KOH、Ca(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、NH4HCO3、NH3•H2O | |
| D. | 碱性氧化物:Na2O、CaO、Al2O3、Fe2O3 |
20.图是198K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
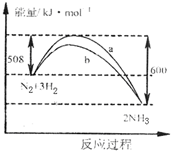

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 mol N2和3 mol H2充分反应后,放出92 kJ热量 | |
| C. | 加入催化剂可增大正反应速度,降低逆反应速率 | |
| D. | b曲线是加入催化剂时的能量变化曲线 |
10.下列有关操作正确的是( )
| A. | FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯 | |
| B. | 用盐酸酸化的高锰酸钾溶液区别苯与甲苯 | |
| C. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
17.在下列物质中,化学键类型完全相同的一组是( )
| A. | CO2和H2O | B. | NaCl和HCl | C. | CCl4和KCl | D. | Mg(OH)2和SO2 |
14.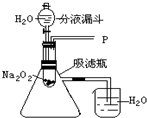 水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
【提出问题】过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
【猜想】
①可能有一种气体和另一种物质生成.
②反应过程中可能有能量变化.
【设计实验】如图所示
实验一:探究反应后生成的气体是什么?
(1)打开如图装置中的分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是O2(或氧气).发生的反应方程式为2Na2O2+2H2O=4NaOH+O2↑其中氧化剂为Na2O2;还原剂为Na2O2;产生0.2mol的氧气,需要的转移电子0.4mol.
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:反应过程中有热量放出,使吸滤瓶内空气受热膨胀.
实验二:继续探究反应后生成的另一种物质是什么?
(3)小强猜想另一种物质是Na2CO3,小明认为不可能,小明的依据是根据质量守恒定律,化学反应前后元素的种类不变,而反应物中不含碳元素.
为了证实小明的看法,请你设计一个证明CO32-不存在的实验.
(4)小明取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的另一种物质是NaOH(填化学式).
 水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:【提出问题】过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
【猜想】
①可能有一种气体和另一种物质生成.
②反应过程中可能有能量变化.
【设计实验】如图所示
实验一:探究反应后生成的气体是什么?
(1)打开如图装置中的分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是O2(或氧气).发生的反应方程式为2Na2O2+2H2O=4NaOH+O2↑其中氧化剂为Na2O2;还原剂为Na2O2;产生0.2mol的氧气,需要的转移电子0.4mol.
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:反应过程中有热量放出,使吸滤瓶内空气受热膨胀.
实验二:继续探究反应后生成的另一种物质是什么?
(3)小强猜想另一种物质是Na2CO3,小明认为不可能,小明的依据是根据质量守恒定律,化学反应前后元素的种类不变,而反应物中不含碳元素.
为了证实小明的看法,请你设计一个证明CO32-不存在的实验.
| 实验步骤 | 实验现象 | 实验结论 |
15.下列有关反应Na2O2+SO2═Na2SO4中Na2O2作用的说法正确的是( )
| A. | 反应中的Na2O2既表现氧化性,又表现还原性 | |
| B. | 反应每消耗1molSO2,Na2O2将得到2mol电子 | |
| C. | 与反应2Na2O2+CO2═2Na2CO3+O2中Na2O2的作用相同 | |
| D. | 与反应Na2O2+H2SO4═Na2SO4+H2O2中Na2O2的作用相同 |